
科目: 来源: 题型:解答题
| 实验 | 20.0mL双氧水溶液浓度 | 粉状MnO2 | 温度 | 待测数据 |
| Ⅰ | 5% | 2.0g | 20℃ | |
| Ⅱ | 5% | 1.0g | 20℃ | |
| Ⅲ | 10% | 1.0g | 20℃ | |
| Ⅳ | ω | 2.0g | 30℃ |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
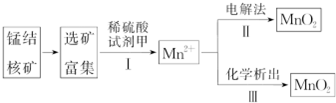
科目: 来源: 题型:解答题
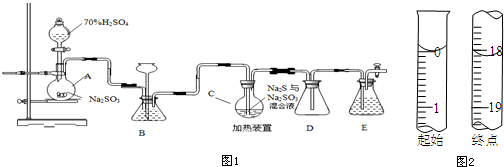
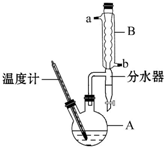 1-溴丙烷常用作有机反应的溶剂.实验室制备1-溴丙烷(CH3CH2CH2Br)的反应和主要实验装置如图:
1-溴丙烷常用作有机反应的溶剂.实验室制备1-溴丙烷(CH3CH2CH2Br)的反应和主要实验装置如图:| 相对分 子质量 | 密度 /g•mL-1 | 沸点/℃ | 水中 溶解性 | |
| 正丙醇 | 60 | 0.896 | 97.1 | 溶 |
| 正丙醚 | 102 | 0.74 | 90 | 几乎不溶 |
| 1-溴丙烷 | 123 | 1.36 | 71 | 不溶 |
查看答案和解析>>
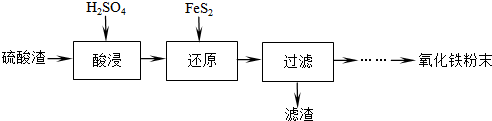
科目: 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
查看答案和解析>>
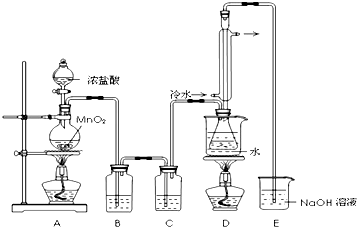
科目: 来源: 题型:解答题
| 物质 | 沸点/℃ | 熔点/℃ |
| S | 445 | 113 |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
查看答案和解析>>
科目: 来源: 题型:解答题
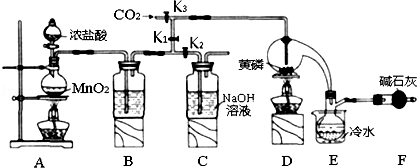
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaOH、Al--电解质 | B. | C2H4、O2--易燃气体 | ||
| C. | CaC2、K--遇湿易燃物品 | D. | KMnO4、KClO3--还原剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 全氟丙烷(C3F8)与全氟甲烷(CF4)互为同系物 | |
| B. | 石墨能导电,所以石墨属于电解质 | |
| C. | 在化学反应中,原子的种类和数目均保持不变 | |
| D. | 干冰的气化、煤的气化均属于物理变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | 次氯酸的电子式: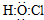 | |
| C. | 氮原子的结构示意图: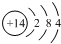 | |
| D. | 碳酸氢钠的电离方程式:NaHCO3=Na++H++CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com