
科目: 来源: 题型:选择题
| A. | 溶液中Na+数目增多 | |
| B. | 溶液中有氢气逸出 | |
| C. | 溶质的质量分数增大 | |
| D. | 溶液质量减少,溶质的质量分数不变 |
查看答案和解析>>
科目: 来源: 题型:实验题

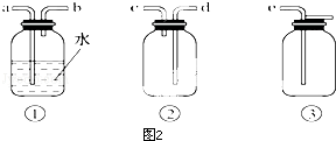
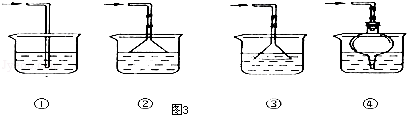
查看答案和解析>>
科目: 来源: 题型:解答题
 甲醇是一种可再生的绿色能源,CO2是一种温室气体,它们都是重要的化工原料.
甲醇是一种可再生的绿色能源,CO2是一种温室气体,它们都是重要的化工原料.查看答案和解析>>
科目: 来源: 题型:解答题
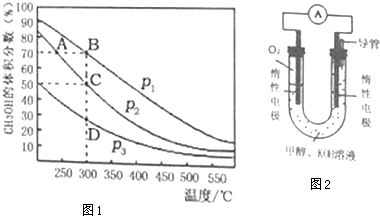
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 蛋白质属于天然有机高分子化合物,没有蛋白质就没有生命 | |
| B. | HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性 | |
| C. | 某些蛋白质跟浓硝酸作用会变黄 | |
| D. | 可以采用多次盐析或多次渗析的方法分离、提纯蛋白质 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 | |
| D. | 将SO2通入品红溶液中,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题

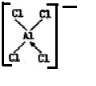 ,[AlCl4]的立体构型名称为正四面体形.
,[AlCl4]的立体构型名称为正四面体形.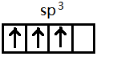 ,铍与铝元素性质相近的原因是Be与Al的电负性相近.
,铍与铝元素性质相近的原因是Be与Al的电负性相近.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com