
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
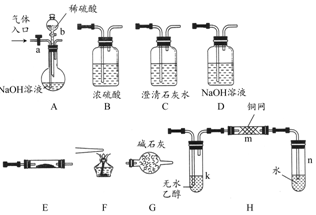 如图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择).
如图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择).查看答案和解析>>
科目: 来源: 题型:实验题
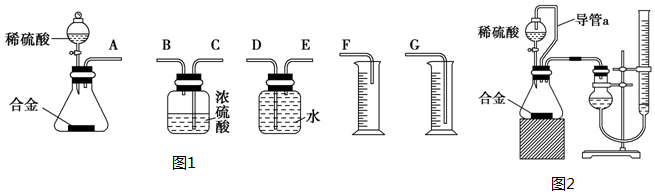
查看答案和解析>>
科目: 来源: 题型:推断题
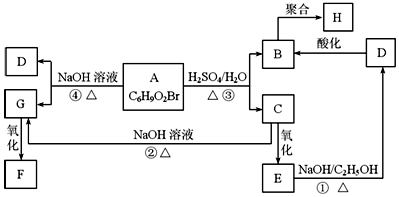 有机物A、B、C、D、E、F、G、H相互转化关系如图所示.5.2g F能与100mL 1mol/L NaOH溶液恰好完全中和,0.1molF还能与足量NaHCO3反应在标准状况下放出4.48LCO2.D的分子式为C3H3O2Na,E的分子中含有羧基.
有机物A、B、C、D、E、F、G、H相互转化关系如图所示.5.2g F能与100mL 1mol/L NaOH溶液恰好完全中和,0.1molF还能与足量NaHCO3反应在标准状况下放出4.48LCO2.D的分子式为C3H3O2Na,E的分子中含有羧基.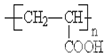 ;
;查看答案和解析>>
科目: 来源: 题型:推断题
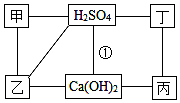 如图中的每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种.
如图中的每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种.查看答案和解析>>
科目: 来源: 题型:解答题
| 编号 | A的初始浓 度/(mol•L-1) | B的初始浓 度/(mol•L-1) | 生成C的初始速 率/(mol•L-1•s-1) |
| 1 | 1.0 | 1.0 | 1.2×10-2 |
| 2 | 2.0 | 1.0 | 2.4×10-2 |
| 3 | 1.0 | 2.0 | 4.8×10-2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 改变的条件 | 结论 |
| A | 升温 | CO32-的水解平衡向右移动 |
| B | 加入AlCl3固体 | 产生大量气体 |
| C | 加入100mLH2O | 溶液中c(H+)、c(OH-)均减小 |
| D | 加入少量CH3COONa固体 | 溶液中n(CO32-)增大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:推断题
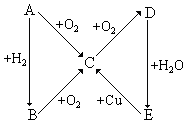 根据如图所示的A、B、C、D、E五种物质的相互转化关系,按如下要求填写相应的物质和有关反应的化学方程式.
根据如图所示的A、B、C、D、E五种物质的相互转化关系,按如下要求填写相应的物质和有关反应的化学方程式.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1L溶液中含阴、阳离子总数是0.6NA | |
| B. | 500mL溶液中Βa2+的浓度是0.2mol•L-1 | |
| C. | 500mL溶液中NO-3的浓度是0.4mol•L-1 | |
| D. | 1L溶液中含有0.2NA个NO-3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com