
科目: 来源: 题型:解答题
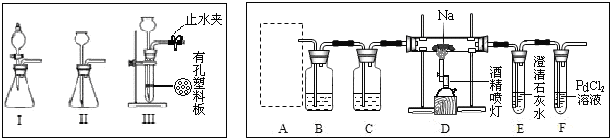
查看答案和解析>>
科目: 来源: 题型:解答题
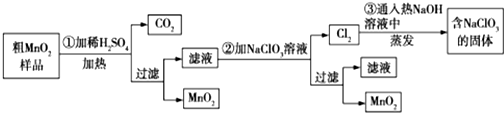
查看答案和解析>>
科目: 来源: 题型:解答题
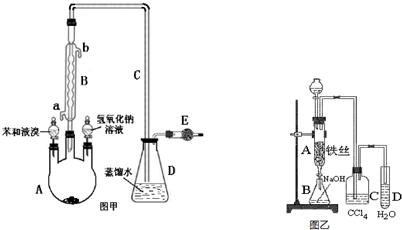
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
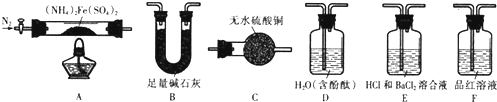
查看答案和解析>>
科目: 来源: 题型:解答题
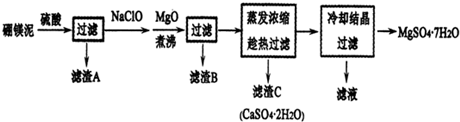
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由反应①、②可推知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1 | |
| B. | 等物质的量的甲烷分别参与反应①、②,则反应转移的电子数相等 | |
| C. | 若用标准状况下4.48 L CH4还原NO2至N2,放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为3.2NA |
查看答案和解析>>
科目: 来源: 题型:解答题
 乙酰苯胺作为一种常用药,具有解热镇痛的效果.实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率.
乙酰苯胺作为一种常用药,具有解热镇痛的效果.实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率.| 名称 | 式量 | 性状 | 密度/g/cm3 | 沸点/℃ | 溶解度 |
| 苯胺 | 93 | 无色油状液体,具有还原性 | 1.02 | 184.4 | 微溶于水,易溶于乙醇、乙醚等 |
| 乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水,易溶于乙醇、乙醚 |
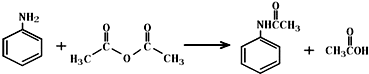
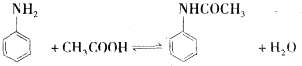 .
.查看答案和解析>>
科目: 来源: 题型:解答题

| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,加入过量2mol/L的盐酸溶液,充分振荡,再滴加几滴0.1mol/L氯化钡溶液 | 有白色沉淀生成说明悬浊液中混有Cu4(OH)6SO4. |
| 步骤2:另取少量悬浊液于试管中,将试管放入装有沸水的小烧杯中水浴加热一段时间取出试管观察 | 试管中有黑色固体生成,说明悬浊液中混有Cu(OH)2. |
查看答案和解析>>
科目: 来源: 题型:解答题
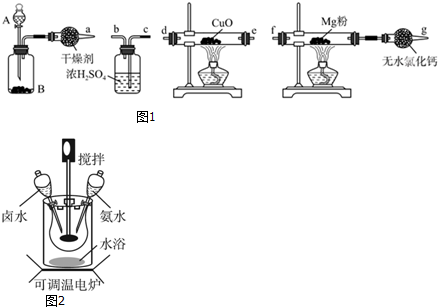
查看答案和解析>>
科目: 来源: 题型:解答题
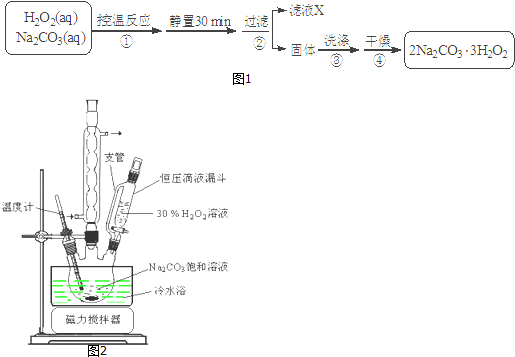
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com