
科目: 来源: 题型:选择题
| A. | H2O(g)=H2(g)+$\frac{1}{2}$ O2(g)△H=+242 kJ/mol | B. | 2H2(g)+O2(g)=2H2O (l)△H=-484 kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$ O2(g)=H2O (g)△H=-242 kJ | D. | 2H2(g)+O2(g)=2H2O (g)△H=+484 kJ/mol |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将溶质用蒸馏水溶解后,未冷却即转移至容量瓶中并定容 | |
| B. | 未洗涤溶解溶质用的烧杯及玻璃棒 | |
| C. | 定容时仰视刻度线观察液面 | |
| D. | 容量瓶中原来含有少量蒸馏水 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
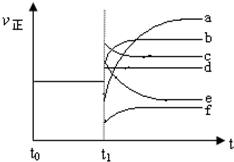 水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:| 容器编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.60① | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正_②>ν逆 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com