
科目: 来源: 题型:选择题
| A. | 将4 g NaOH溶解在1L蒸馏水中 | |
| B. | 用托盘天平称量5.85g NaCl固体溶于蒸馏水,配成1000mL溶液 | |
| C. | 常温常压下,将11.2L HCl气体溶于蒸馏水,配成500mL溶液 | |
| D. | 取50 mL 0.5mol/L 的KNO3溶液用蒸馏水稀释,配成250mL 溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶解搅拌时有液体飞溅 | |
| B. | 取KMnO4样品时不慎在表面沾了点蒸馏水 | |
| C. | 定容时俯视容量瓶刻度线 | |
| D. | 定容摇匀后见液面下降,再加水至刻度线 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2165kJ•mol-1 | |
| B. | B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2033kJ•mol-1 | |
| C. | B2H6(g)+3O2(g)═B2O3+3H2O△H=-2165kJ•mol-1 | |
| D. | B2H6(g)+O2(g)═B2O3(s)+H2O(l)△H=-2165kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 10min内,反应放出的热量为197kJ热量 | |
| B. | 10min内,X的平均反应速率为0.06mol•L-1•min-1 | |
| C. | 第10min时,Y的反应速率小于0.015mol•L-1•min-1(假如体系温度不变) | |
| D. | 第10min时,Z浓度为0.6mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 浓硫酸(H2SO4)500mL | |
| 浓度(质量分数) | 98% |
| 密度 | 1.81g•cm-3 |
| 相对分子质量 | 98 |
| 强腐蚀性,阴冷,密封贮藏 | |
查看答案和解析>>
科目: 来源: 题型:解答题
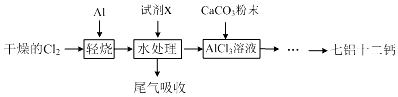
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.5 | 4.7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 容量瓶容积 | 固体质量 | 实验操作 |
| A | 180mL | SrCl2:28.6g | 加入180mL水 |
| B | 200mL | SrCl2:31.8g | 配成200mL溶液 |
| C | 250mL | SrCl2:39.8g | 配成250mL溶液 |
| D | 250mL | SrCl2•2H2O:39.8g | 配成250mL溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:实验题
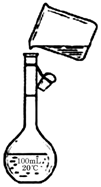 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):查看答案和解析>>
科目: 来源: 题型:推断题
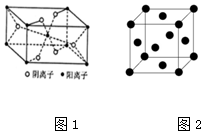 W、X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;W是形成有机物种类最多的元素;R2+的3d轨道中有9个电子.请回答:
W、X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;W是形成有机物种类最多的元素;R2+的3d轨道中有9个电子.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com