
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 16mol | B. | 6mol | C. | 12mol | D. | 4mol |
查看答案和解析>>
科目: 来源: 题型:实验题
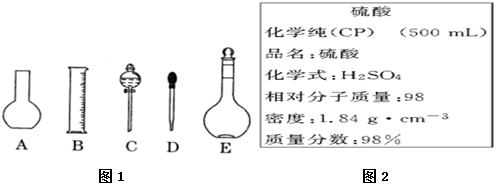
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验室将硫酸铜溶液直接加热蒸干来制取CuSO4•5H2O | |
| B. | 用湿润的pH试纸来测溶液的pH | |
| C. | 不慎将浓碱溶液沾到皮肤上,可先立即用稀盐酸中和,后用大量水冲洗,再涂上2%~5%的硼酸溶液 | |
| D. | 用四氯化碳萃取溴水中的溴 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用到的玻璃仪器有:玻璃棒、胶头滴管、500mL容量瓶、烧杯 | |
| B. | 需要称量氢氧化钠固体1.92g | |
| C. | 没有等溶液冷却就转移将导致所配溶液浓度偏高 | |
| D. | 洗净的容量瓶不需要干燥就能使用,但使用前需检漏 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ•mol-1 | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-484kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com