
科目: 来源: 题型:填空题
 已知乙醇可以和氯化钙反应生成微溶于水的CaCl2•6C2H5OH.
已知乙醇可以和氯化钙反应生成微溶于水的CaCl2•6C2H5OH.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{1}{\sqrt{a}}$ | B. | $\sqrt{a}$ | C. | $\frac{1}{2}$a | D. | $\frac{1}{\frac{1}{2}a}$ |
查看答案和解析>>
科目: 来源: 题型:填空题
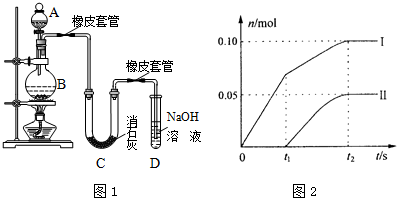
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:填空题
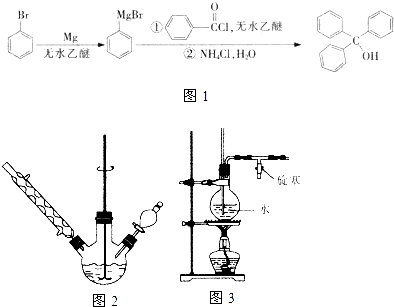 三苯甲醇是一种重要有机合成中间体,可以通过下列原理进行合成:实验步骤如下:
三苯甲醇是一种重要有机合成中间体,可以通过下列原理进行合成:实验步骤如下:查看答案和解析>>
科目: 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系 能量的变化 | ||||
| CO | H2O | CO2 | H2 | |||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8kJ | |
| A. | 容器①中反应达平衡时,CO的转化率为80% | |
| B. | 平衡时,两容器中CO2的浓度相等 | |
| C. | 容器①中CO的转化率等于容器②中CO2的转化率 | |
| D. | 容器①中CO反应速率等于H2O(g)的反应速率 |
查看答案和解析>>
科目: 来源: 题型:填空题
 (1)实验室用如图所示装置制备少量乙酸乙酯.
(1)实验室用如图所示装置制备少量乙酸乙酯.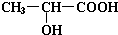 .试回答:
.试回答: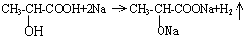 ;
;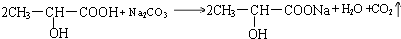 .
.查看答案和解析>>
科目: 来源: 题型:填空题
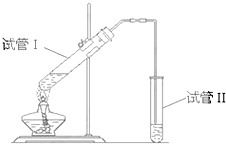 如图所示装置,该装置用于制备少量乙酸乙酯,请回答:
如图所示装置,该装置用于制备少量乙酸乙酯,请回答:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-=CaCO3↓+2OH- | |
| C. | 氢氧化钠溶液中通入过量CO2:OH-+CO2=HCO3- | |
| D. | FeCl3溶液与Cu反应:Cu+Fe3+=Cu2++Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com