
科目: 来源: 题型:解答题
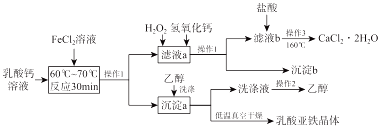
查看答案和解析>>
科目: 来源: 题型:解答题
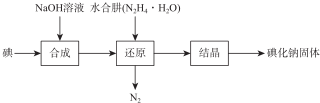
| 测定 序号 | 待测液体积/mL | 标准液滴定管起点读数/mL | 标准液滴定管终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
查看答案和解析>>
科目: 来源: 题型:实验题

| 物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 乙酰苯胺 | 114.3 | 305 | 微溶于冷水,易溶于热水 |
| 苯胺 | -6 | 184.4 | 微溶于水 |
| 醋酸 | 16.6 | 118 | 易溶于水 |
查看答案和解析>>
科目: 来源: 题型:解答题
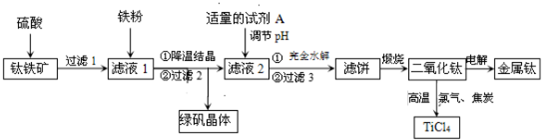
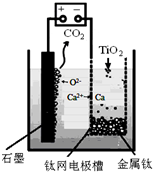
查看答案和解析>>
科目: 来源: 题型:解答题
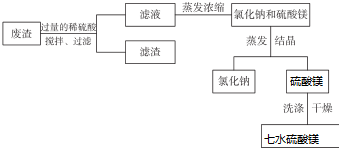
查看答案和解析>>
科目: 来源: 题型:实验题
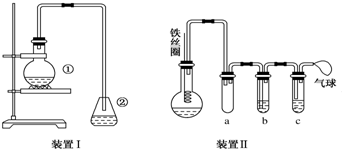
 .②中离子方程式为Br-+Ag+═AgBr↓.
.②中离子方程式为Br-+Ag+═AgBr↓. 与Br2,要想得到纯净的产物,可用NaOH溶液试剂洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.
与Br2,要想得到纯净的产物,可用NaOH溶液试剂洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
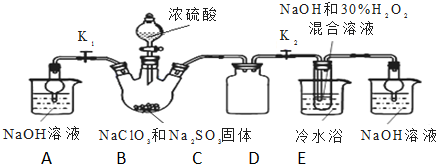
查看答案和解析>>
科目: 来源: 题型:解答题
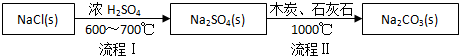
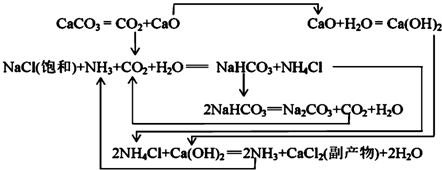
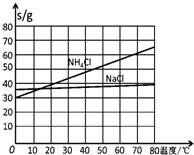
| NaCl | NH4Cl | NaHCO3 | NH4HCO3 | Na2CO3 |
| 35.9 | 37.2 | 9.6 | 21.7 | 21.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com