
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

| 氢氧化物 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题
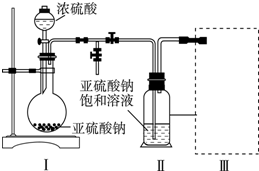
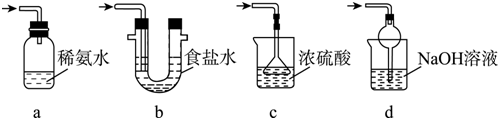
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁与水蒸气反应的产物是黑色的Fe2O3 | |
| B. | 红热的铁能与水蒸气反应,放出的气体点燃时能发出爆鸣声 | |
| C. | 铁与水蒸气的反应是氧化还原反应 | |
| D. | 常温下,Fe与H2O不反应,但在空气中的O2、H2O共同作用下能发生反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NO | B. | N2O | C. | NO2 | D. | N2O3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 盛浓盐酸的分液漏斗可用长颈漏斗代替 | |
| B. | 可在集气瓶口放一张湿润的淀粉碘化钾试纸,观察氯气是否收集满 | |
| C. | 用饱和食盐水吸收尾气 | |
| D. | 为了便于学生观察氯气的制备实验,可在讲台上直接做氯气的制备实验 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com