
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
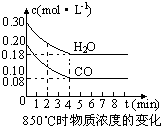 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 6 |
| V |
| 6 |
| V |
| 4 |
| V |
| 4 |
| V |
| 0.2 |
| V |
| 0.2 |
| V |
查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com