
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 纯碱(Na2CO3)从物质的分类看不属于碱 | |
| B. | 由一种元素组成的物质一定是单质 | |
| C. | 凡是能电离出H+的化合物均属于酸 | |
| D. | 盐类物质一定含有金属离子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4+、Fe3+、SO42-、Cl- | B. | Mg2+、Ag+、CO32-、Cl- | ||
| C. | K+、NH4+、SO42-、Cl- | D. | K+、Na+、NO3-、HCO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaOH 溶液和CO2 的反应 | B. | Ba(OH)2 溶液和稀H2SO4 的反应 | ||
| C. | NaHSO4溶液和KOH 反应 | D. | 石灰乳和稀H2SO4 的反应 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 纯净物:水银、氢氧化铁固体、冰水混合物 | |
| B. | 碱性氧化物:Na2O、Na2O2、Al2O3 | |
| C. | 盐:纯碱、小苏打、烧碱 | |
| D. | 电解质:CH3COOH、H2O、NH3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④ | B. | ②③①④ | C. | ②①③④ | D. | ③②④① |
查看答案和解析>>
科目: 来源: 题型:解答题
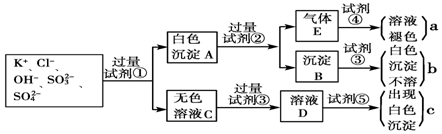
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SO2和SiO2 | B. | CO2和CH4 | C. | NaCl和HCl | D. | CCl4和H2O2 |
查看答案和解析>>
科目: 来源: 题型:填空题
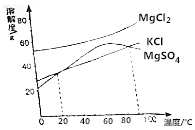 我国食盐有80%来自底下井盐和岩盐,用盐井水晒盐是制取食盐的常用方法.
我国食盐有80%来自底下井盐和岩盐,用盐井水晒盐是制取食盐的常用方法.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com