
科目: 来源: 题型:解答题
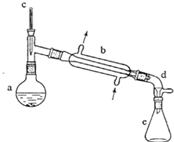 (醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
(醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: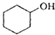 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O
+H2O| 相对分子质量 | 密度/(g•cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
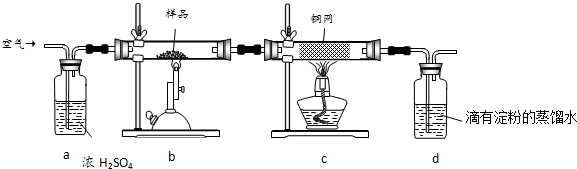

查看答案和解析>>
科目: 来源: 题型:解答题
| 化学键 | H-H | C=O | C═O | C-H |
| E/(kJ•mol-1) | 436 | 803 | 1070 | 413 |
查看答案和解析>>
科目: 来源: 题型:解答题
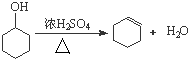
 某化学小组以环己醇
某化学小组以环己醇 制备环己烯:已知
制备环己烯:已知| 密度(g/cm3) | 溶点(℃) | 沸点(℃) | 溶解性 | |
| 环已醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环已烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目: 来源: 题型:解答题
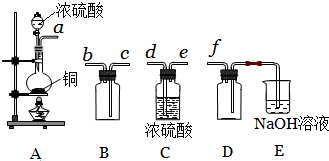
查看答案和解析>>
科目: 来源: 题型:实验题
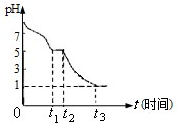 连二亚硫酸钠(Na2S2O4),又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验:
连二亚硫酸钠(Na2S2O4),又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验:| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
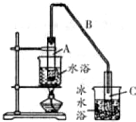
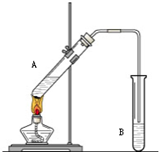 用如图所示装置制取乙酸乙酯.请回答下列问题:
用如图所示装置制取乙酸乙酯.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:实验题

| 密度(g•cm-3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
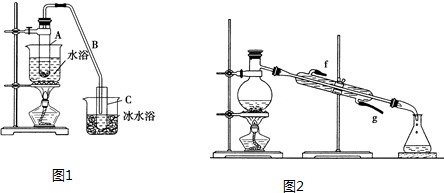
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com