
科目: 来源: 题型:实验题
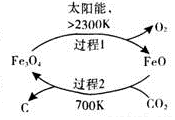
 已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验结果(假设产生的气体完全被吸收):
已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验结果(假设产生的气体完全被吸收):| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 102.9g |
| (石灰水+广口瓶)的质量 | 312.0g | 314.2g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaHSO3溶液与NaOH溶液反应:HSO3-+OH-═SO32-+H2O | |
| B. | 少量二氧化碳通入足量的NaOH溶液:CO2+2OH-═CO32-+H2O | |
| C. | Ba(OH)2与H2SO4反应:H++OH-═H2O | |
| D. | 氨水和醋酸溶液混合:NH3•H2O+CH3COOH═NH4++CH3COO-+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3OH的燃烧热为192.9kJ/mol | |
| B. | 反应①要吸收热量,故反应②更实用些 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9kJ/mol |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol | |
| B. | 一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3放热akJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-2akJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=-114.6kJ/mol |
查看答案和解析>>
科目: 来源: 题型:解答题
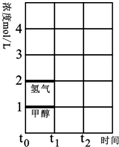
 二氧化碳的回收利用是环保领域研究热点.
二氧化碳的回收利用是环保领域研究热点.
| 时间(min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
| CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
| CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
查看答案和解析>>
科目: 来源: 题型:解答题
 煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目: 来源: 题型:实验题
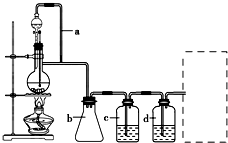 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:查看答案和解析>>
科目: 来源: 题型:解答题
| 成 分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶于酸的物质 |
| 质量分数/% | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
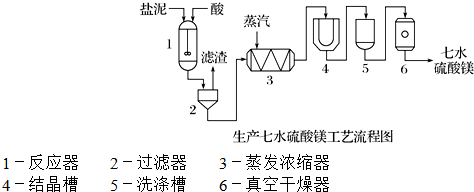
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com