
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 原溶液中c(Fe3+)=0.2mol•L-1 | |
| B. | SO42-、NH4+、Na+一定存在,CO32-一定不存在 | |
| C. | 要确定原溶液中是否含有Fe2+,其操作为取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+ | |
| D. | 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 当b>2a时,发生的离子反应为:CO32-+2H+=H2O+CO2↑ | |
| B. | 当b<a时,发生的离子反应为:CO32-+H+=HCO3- | |
| C. | 当4a=3b时,发生的离子反应为:3CO32-+4H+=2HCO3-+CO2↑+H2O | |
| D. | 当a<b<2a时,反应生成的HCO3-与CO2的物质的量之比为(b-a):(2b-a) |
查看答案和解析>>
科目: 来源: 题型:选择题
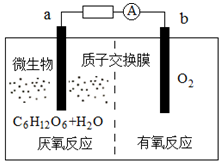 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法正确的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法正确的是( )| A. | b极为正极,发生氧化反应 | |
| B. | 外电路中电子的移动方向为:b→a | |
| C. | 质子通过交换膜从b极区移向a极区 | |
| D. | 电池总反应为C6H12O6+6O2=6CO2+6H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 中和反应的反应热测定需用温度计测量温度二次,分别为反应的起始温度和最高温度 | |
| B. | 用试纸检验气体时,可先把试纸用蒸馏水润湿,粘在玻璃棒一端,用玻璃棒把试纸放到盛待测气体的容器口附近 | |
| C. | 用剩的药品能否放回原瓶,应视具体情况而定 | |
| D. | 将铂丝放在盐酸中洗涤并灼烧为无色后,再蘸取待测物进行焰色反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1molCH4与4molCl2在光照下完全反应可生成1molCCl4 | |
| B. | 甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应 | |
| C. | 乙烯能被酸性高锰酸钾溶液氧化,而苯不易 | |
| D. | 1体积的C2H4完全燃烧需同温同压下3体积的O2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 126C和146C是2种核素,他们互称同位素 | |
| B. | 近期化学研究者开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性.纳米泡沫碳与C60互称同素异形体 | |
| C. |  与 与 互为同分异构体 互为同分异构体 | |
| D. | 硝基苯可看成是由  和-NO2两种基团组成 和-NO2两种基团组成 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 其他条件不变,增大该体系的压强,平衡正向移动,则C为气体 | |
| B. | 其他条件不变.若升高温度.B的平衡转化率增大.则该反应是放热反应 | |
| C. | 该反应的化学平衡常数表达式为K=$\frac{{c}^{4}(C)•{c}^{2}(D)}{{c}^{3}(A)•{c}^{2}(B)}$ | |
| D. | 此时.B的平衡转化率是40% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com