
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
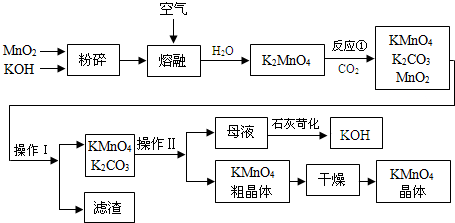

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4+、Ba2+、Cl-、NO3- | B. | K+、Na+、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、SO32- |
查看答案和解析>>
科目: 来源: 题型:填空题
 铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O.
铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O.查看答案和解析>>
科目: 来源: 题型:多选题
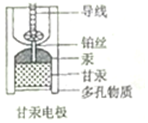 饱和甘汞电极(Hg-Hg2Cl2)因其电动势稳定,常被用作参比电极,其内部构造如图所示,当甘汞电极与锌共同插入ZnCl2溶液中构成原电池时,下列说法正确的是( )
饱和甘汞电极(Hg-Hg2Cl2)因其电动势稳定,常被用作参比电极,其内部构造如图所示,当甘汞电极与锌共同插入ZnCl2溶液中构成原电池时,下列说法正确的是( )| A. | 负极的电极反应式为Zn-2e-═Zn2+ | |
| B. | 正极的电极反应式为Hg2Cl2+2e-═2Hg+2Cl- | |
| C. | 多孔物质相当于盐桥 | |
| D. | 甘汞电极中,Cl-既不是反应物,也不是产物 |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:推断题
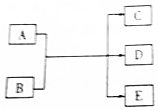 一定条件下,物质A~E转化关系如图,其中A为单质,B为化合物,常温下E为无色液体.
一定条件下,物质A~E转化关系如图,其中A为单质,B为化合物,常温下E为无色液体. ,所含化学键类型为离子键、共价键,A与B反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O;D溶液可使KI淀粉溶液显蓝色,则D与KI溶液反应的离子方程式是2H++2I-+ClO-=Cl-+H2O+I2.
,所含化学键类型为离子键、共价键,A与B反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O;D溶液可使KI淀粉溶液显蓝色,则D与KI溶液反应的离子方程式是2H++2I-+ClO-=Cl-+H2O+I2.查看答案和解析>>
科目: 来源: 题型:选择题
| 实验 | 操作 | |
| A | 证明某溶液中存在Fe2+ | 先加少量氯水,再滴加KSCN溶液,出现血红色 |
| B | 测定熔融苛性钠的导电性 | 在瓷坩埚中熔化氢氧化钠固体后进行测量 |
| C | 证明氯的非金属性大于碳 | 向碳酸钙中滴加盐酸,有气泡产生 |
| D | 制备氯化镁晶体 | 将MgCl2溶液在氯化氢的气流中蒸干 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com