
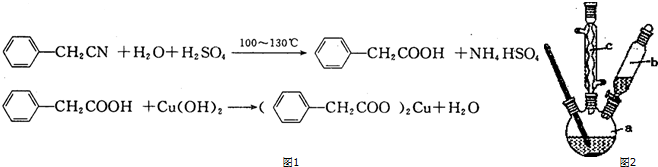
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 11.1% | B. | 22.2% | C. | 33.3% | D. | 37.8% |
查看答案和解析>>
科目: 来源: 题型:选择题
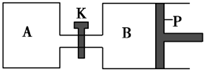 如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ•mol-1(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达平衡,A中C的浓度为w1 mol•L-1,放出热量b kJ,B中C的浓度为w2 mol•L-1,放出热量c kJ.下列说法错误的是( )
如图所示的装置中发生反应2A2(g)+B2(g)?2C(g)△H=-a kJ•mol-1(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向A、B容器中分别充入2mol A2和1mol B2,两容器分别在500℃时达平衡,A中C的浓度为w1 mol•L-1,放出热量b kJ,B中C的浓度为w2 mol•L-1,放出热量c kJ.下列说法错误的是( )| A. | 此反应的平衡常数表达式为K=$\frac{{c}^{2}(C)}{{c}^{2}({A}_{2})•c({B}_{2})}$ | |
| B. | C的浓度大小比较为:w2<w1 | |
| C. | a、b、c由大到小的关系为a>c>b | |
| D. | 若打开K,一段时间后重新达平衡,容器B的体积将减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
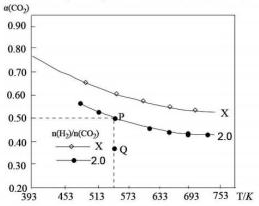 在两个固定体积均为1L密闭容器中以不同的氢碳化比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个固定体积均为1L密闭容器中以不同的氢碳化比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )| A. | 该反应在高温下自发进行 | |
| B. | 氢碳比:X<2.0 | |
| C. | 若起始时,CO2、H2、浓度分分别为0.5mol/L和1.0mol/L,则可得P点,对应温度的平衡常数的值为512 | |
| D. | 向处于P点状态的容器中,按2:4:1:4的比例再充入CO2、H2、C2H4、H2O,再次平衡后a(CO2)减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A. | 反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.10molSO3和0.010 molO2,到达平衡时,n(SO2)=0.012 mol | |
| C. | 保持其他条件不变,升高温度,平衡时c(SO2)=0.0070mol•L-1,则反应的△H>0 | |
| D. | 相同温度下,起始时向容器中充入0.050molSO2和0.030molO2,达到平衡时SO2转化率大于88% |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
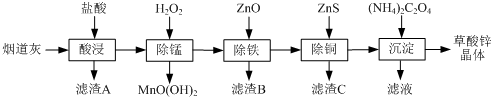
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
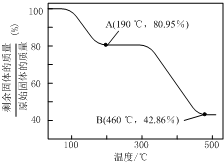
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com