17.
柠檬酸铁铵是一种铁质强化剂,可治疗缺铁性贫血.该盐极易潮解,溶于水,不溶于乙醇、乙醚等有机溶剂,见光易转化为亚铁盐.其实验室制备过程和工业生产流程分别如下:
(一)实验室制备过程:
FeSO
4溶液$→_{①}^{NaClO_{3}/80℃}$Fe
2(SO
4)
3$→_{②}^{NH_{3}H_{2}O}$Fe(OH)
3↓$→_{③}^{C_{6}H_{5}O_{7}H_{3}}$Fe(C
6H
5O
7)$→_{④}^{氨水}$(NH
4)
3Fe(C
6H
5O
7)
2(二)工业生产流程:
硫酸亚铁$→_{①}^{氯化钠}$氢氧化铁$→_{②}^{柠檬酸}$成盐$→_{③}^{氨水/柠檬酸}$溶液$\stackrel{过滤}{→}$滤液→…$\stackrel{洗涤}{→}$ $\stackrel{干燥}{→}$成品
已知:
Fe(OH)
3+C
6H
5O
7H
3(柠檬酸)═Fe(C
6H
5O
7)(柠檬酸铁)+3H
2O
3NH
3•H
2O+C
6H
5O
7H
3(柠檬酸)═(NH
4)
3C
6H
5O
7(柠檬酸铵)+3H
2O
Fe(C
6H
5O
7)+(NH
4)
3C
6H
5O
7═(NH
4)
3Fe(C
6H
5O
7)
2(柠檬酸铁铵)
请回答下列问题:
(一)实验室制备过程中,高纯度、合适紧密结构的氢氧化铁制备是生成柠檬酸铁铵的关键步骤:
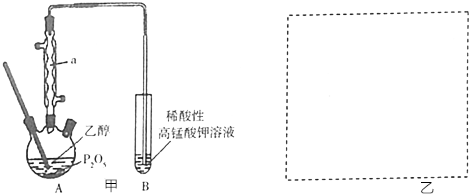
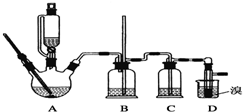
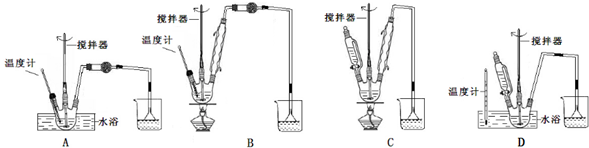
(1)第①步中氯酸钠氧化硫酸亚铁时,下列装置最适合的是D.
(2)若要检验第①步反应后的溶液中不存在Fe
2+,下列试剂最合适的是D.
A.KSCN溶液 B.KSCN溶液和氯水
C.酸性高锰酸钾溶液 D.铁氰化钾溶液
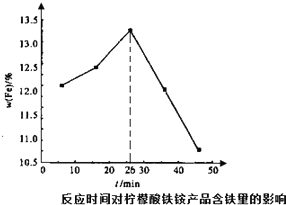
(3)第②步中反应时间与产品的含铁量的关系如图所示,在26min后含铁量随着反应时间的延长而降低,其主要原因是反应时间过长,产生结构紧密的氢氧化铁,难以被柠檬酸溶解,导致产品含铁量降低.请分析26min前含铁量随着反应时间的延长而增加的主要原因是26min前随着滴加时间的延长氨水与硫酸铁反应更充分,产生更多结构合适易被柠檬酸溶解的氢氧化铁,从而增加含铁量.
(4)检验氢氧化铁是否完全洗涤干净的具体实验操作是取少量最后一次洗涤液于2支试管中,分别滴加酸化的BaCl
2、AgNO
3溶液,均无白色沉淀产生,证明洗涤干净.
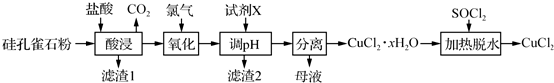
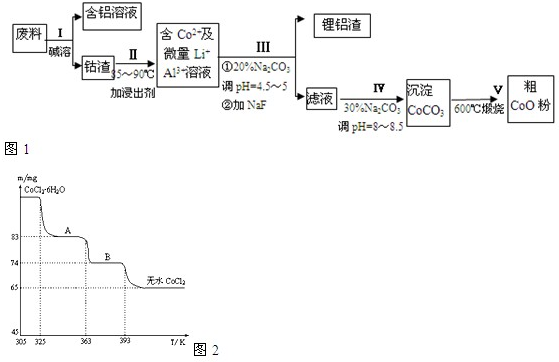
(二)在工业生产流程中
(5)下列关于工业生产流程的说法正确的是AC.
A.第①步用大量的NaClO
3氧化Fe
2+时,可消耗H
+,促进产生的Fe
3+水解产生Fe(OH)
3B.第①步中的NaClO
3可以用稀硝酸溶液代替
C.第②步中为加快Fe(OH)
3的溶解速率,可采用搅拌或适当升高温度
D.第③步中的柠檬酸是起调节溶液pH作用,可用稀硫酸代替
(6)第④步后,为制得成品,后续操作步骤是蒸发浓缩、冷却结晶、过滤.
(7)在室温下,将所得的成品用无水乙醇进行浸泡2次,从而得到精制产品,选择用无水乙醇进行浸泡的优点是①无水乙醇可溶解柠檬酸等有机杂质,提高产品纯度;②减少柠檬酸铁铵的溶解损失;③乙醇易挥发,不易残留.(写出两点)



 柠檬酸铁铵是一种铁质强化剂,可治疗缺铁性贫血.该盐极易潮解,溶于水,不溶于乙醇、乙醚等有机溶剂,见光易转化为亚铁盐.其实验室制备过程和工业生产流程分别如下:
柠檬酸铁铵是一种铁质强化剂,可治疗缺铁性贫血.该盐极易潮解,溶于水,不溶于乙醇、乙醚等有机溶剂,见光易转化为亚铁盐.其实验室制备过程和工业生产流程分别如下:
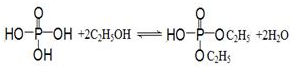 .
.