
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
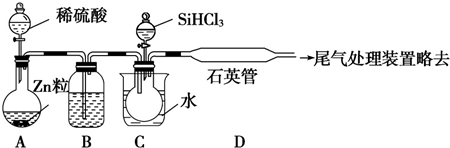
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 平衡时c(NH3)=5mol/L | |
| B. | 平衡时HI分解率为20% | |
| C. | 混合气体的平均摩尔质量不再发生变化不可以作为判断该反应达到平衡状态的标志 | |
| D. | 平衡后缩小容器体积,NH4I的物质的量增加,I2的物质的量不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 60% | B. | 40% | C. | 24% | D. | 4% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 90% | B. | 80% | C. | 45% | D. | 10% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 36 | B. | 30 | C. | 25 | D. | 20 |
查看答案和解析>>
科目: 来源: 题型:实验题
 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯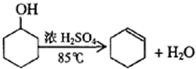
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com