
科目: 来源: 题型:多选题
| A. | 用物质A表示2 s内的平均反应速率为0.3 mol/(L•s) | |
| B. | 用物质B表示2s内的平均反应速率为0.6 mol/(L•s) | |
| C. | 2 s后物质B的浓度为0.35 mol/L | |
| D. | 2 s后物质A的转化率为30% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 平衡后CO的体积分数为40% | |
| B. | 平衡后CO的转化率为25% | |
| C. | 平衡后水的转化率为50% | |
| D. | 平衡后混合气体的平均相对分子质量为24 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 托盘天平称取NaCl的质量 | 应选用容量瓶的规格(可供选择的规格100mL、250mL、500mL) | 除容量瓶外还需要的其它仪器 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
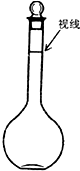 实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:
实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
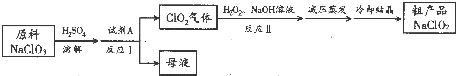
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com