
科目: 来源: 题型:解答题
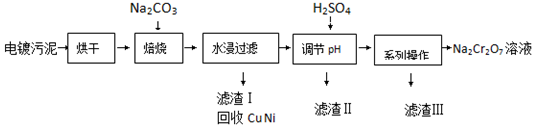
| 20℃ | 60℃ | 100℃ | |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
查看答案和解析>>
科目: 来源: 题型:实验题
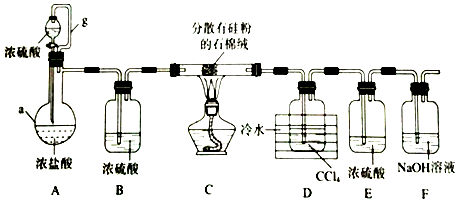
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 工业上可以电解熔融的氯化镁或氯化铝制得相应的金属单质 | |
| B. | Cl2、Br2、I2都具有强氧化性,都能将铁氧化成+3价的铁盐 | |
| C. | 二氧化碳和二氧化硫都是氧化物,两者都不能和氯化钙溶液反应 | |
| D. | 氧化铁和氧化亚铁都是碱性氧化物,和硝酸反应都只生成盐和水 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2p1>p2 | B. | PCl5的分解率增大 | ||
| C. | p1>p2 | D. | Cl2的体积分数增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该反应条件下,初始时向容器中充入2molSO2和1molO2,反应平衡时,可以释放198.0 kJ的热量 | |
| B. | 达到平衡时,SO2和SO3的浓度一定相等 | |
| C. | 反应体系中,当混合物的密度保持不变,反应达到平衡 | |
| D. | 增大压强和升高温度有利于加快反应速率,但升高温度对平衡转化率不利 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3.2g S在反应中转移电子数为0.2NA | |
| B. | 0.1mol Fe在反应中转移电子数为0.3NA | |
| C. | 6.5g Zn在反应中转移电子数为0.2NA | |
| D. | 11.2L O2在反应中转移电子数为0.2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2v正(B)=v逆(C) | B. | 该体系的密度都不随时间变化 | ||
| C. | 1molA断裂,同时1molC也断裂 | D. | 该体系的温度不随时间而变化 |
查看答案和解析>>
科目: 来源: 题型:实验题
 | 初始pH | V(KMnO4)/mL | V(H2C2O4)/mL | V(H2O)/mL |
| ① | 4 | 20 | 10 | |
| ② | 5 | 10 | 5 | |
| ③ | 20 | 10 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②中水的电离程度的是①的8倍 | |
| B. | ①和③中水的电离程度相等 | |
| C. | 等体积的①和④混合后所得溶液中:c(NH3•H2O)<c(NH4+) | |
| D. | ②中水的电离程度等于④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com