
科目: 来源: 题型:解答题
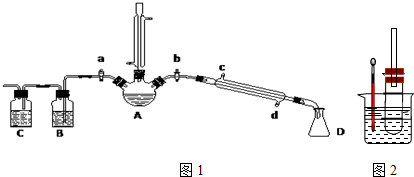
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子式为C2H4O2的有机物不一定有酸性 | |
| B. | 当物质中的化学键发生断裂时,一定发生化学变化 | |
| C. | 等质量的Al分别按a、b两种途径完全转化,途径a比途径b产生的H2多 途径a:Al$\stackrel{HCl}{→}$H2 途径b:Al$\stackrel{Fe_{2}O_{3}}{→}$Fe$\stackrel{HCl}{→}$H2 | |
| D. | 只由一种元素的阳离子与另一种元素的阴离子组成的物质不一定是纯净物 |
查看答案和解析>>
科目: 来源: 题型:解答题
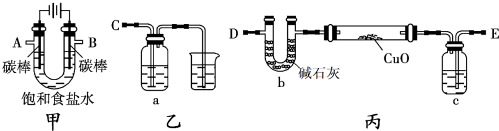
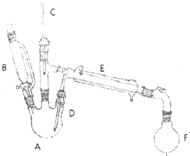 溴乙烷是有机合成的重要原料,实验室合成溴乙烷的装置示意图、相关原理和数据如下:
溴乙烷是有机合成的重要原料,实验室合成溴乙烷的装置示意图、相关原理和数据如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解度 | |
| 乙醇 | 46 | 0.789 | 78.3 | 易溶 |
| 溴乙烷 | 109 | 1.46 | 38.2 | 难溶 |
| 浓硫酸(H2SO4) | 98 | 1.84 | 338.0 | 易溶 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | Ⅱ中主要反应的热化学方程式:S(s)+O2(g)═SO2(g)△H=-297kJ•mol-1 | |
| B. | Ⅳ中主要反应的化学方程式:2SO2+O2$?_{△}^{催化剂}$2SO3 | |
| C. | Ⅳ中使用催化剂可提高化学反应速率和平衡转化率 | |
| D. | Ⅴ中气体a 可以直接排放到大气中 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
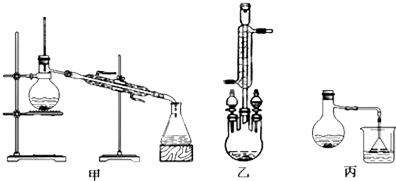
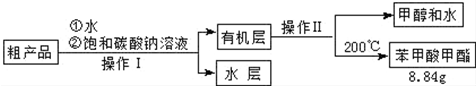
查看答案和解析>>
科目: 来源: 题型:解答题
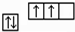 ;其2p能级的轨道有3个伸展方向,电子云的形状为纺锤形.
;其2p能级的轨道有3个伸展方向,电子云的形状为纺锤形.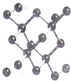
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
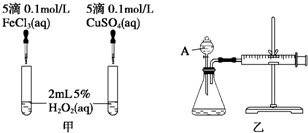
查看答案和解析>>
科目: 来源: 题型:填空题
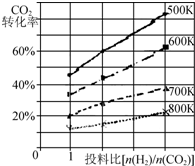 将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g);△H
将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g);△H查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com