
科目: 来源: 题型:选择题
| A. | 若X的反应速率为0.2 mol/(L•s),则Z的反应速率为0.3 mol/(L•s) | |
| B. | 若向容器中充入氦气,压强增大,Y的转化率提高 | |
| C. | 升高温度,正反应速率减小,平衡向逆反应方向移动 | |
| D. | 开始充入容器中的X、Y物质的量之比为2:1 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:推断题
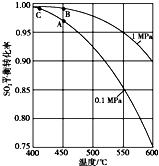 硫酸工业的生产工艺流程可简略表示如下:
硫酸工业的生产工艺流程可简略表示如下: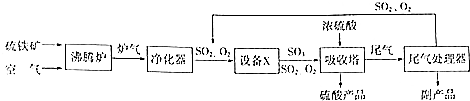 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目: 来源: 题型:实验题
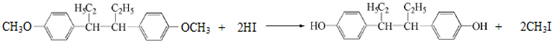 .
.
查看答案和解析>>
科目: 来源: 题型:解答题
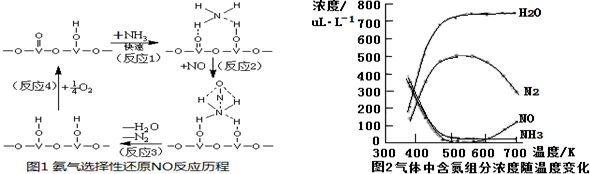

查看答案和解析>>
科目: 来源: 题型:解答题
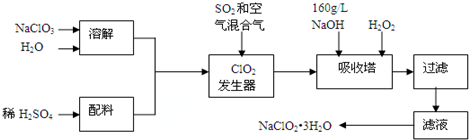
查看答案和解析>>
科目: 来源: 题型:解答题
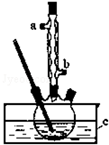 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:2C3CH2CH2CH2OH$→_{135°}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:2C3CH2CH2CH2OH$→_{135°}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O查看答案和解析>>
科目: 来源: 题型:解答题
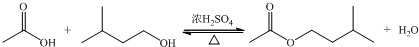
| 相对分子质量 | 密度/(g?cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |

查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题
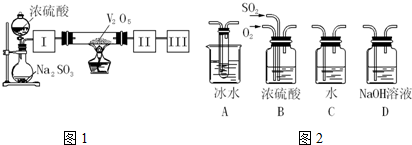
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com