
科目: 来源: 题型:选择题
| A. | 向装置中通入氮气且保持体积不变 | |
| B. | 向装置中通入稍过量氧气且保持体积不变 | |
| C. | 添加更多的催化剂 | |
| D. | 降低温度,及时转移SO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | N2O4(g)═2NO2(g),改变某一条件后,气体颜色加深 | |
| B. | H2(g)+I2(g)═2HI(g),单位时间内消耗H2和HI的物质的量之比大于1:2 | |
| C. | N2(g)+3H2(g)═2NH3(g),改变某一条件后,NH3的体积分数增加 | |
| D. | 2SO2(g)+O2(g)═2SO3(g),恒温恒压条件下,充入He |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | C的体积分数降低 | B. | x+y>z | ||
| C. | 平衡向正反应方向移动 | D. | x+y<z |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | N2将完全转化为NH3 | |
| B. | N2、H2、和NH3的物质的量浓度相等 | |
| C. | N2、H2、和NH3的物质的量浓度不在变化 | |
| D. | 正反应和逆反应的速率都为零 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使用合适的催化剂可以加大反应速率 | |
| B. | 升高温度可以增大反应速率 | |
| C. | 无论如何增大H2浓度,都不能使N2转化率达到100% | |
| D. | 缩小体积,υ正增大,υ逆减小,平衡正向移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 充入N2,容器内压强增大,增加了单位体积内活化分子数,反应速率加快 | |
| B. | 反应进行的净速率是正、逆反应速率之差 | |
| C. | O2的消耗速率与SO3的生成速率之比为2:1 | |
| D. | 加入SO2,可使单位体积内活化分子百分比增多,加快反应速率 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 化学键 | H-H | C-O |  | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 当电池正极消耗mg气体时,电解池阴极同时有mg气体生成 | |
| B. | 电解后c(Na+)与c(CO32-)的比值变小 | |
| C. | 电池中c(KOH)不变;电解池中溶液pH变大 | |
| D. | 电解后c(Na2CO3)不变 |
查看答案和解析>>
科目: 来源: 题型:实验题
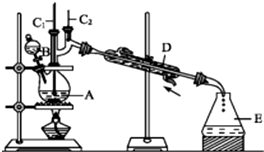 正丁醛是一种化工原料.
正丁醛是一种化工原料.| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com