
科目: 来源: 题型:实验题

 ;该反应的类型为取代.
;该反应的类型为取代.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
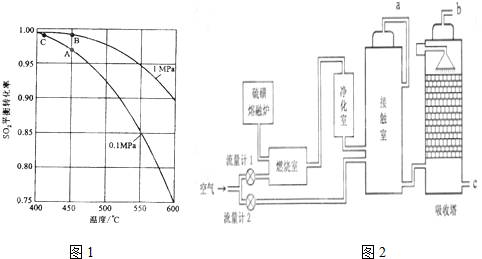
查看答案和解析>>
科目: 来源: 题型:推断题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第三周期元素的最高正化合价等于它所处的族序数 | |
| B. | 主族族序数与价电子数相同 | |
| C. | 非金属元素在化合物中既可显正价又可显负价 | |
| D. | 所有非金属元素的负化合价等于使原子达到8电子稳定结构所需得到的电子数 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钠原子失电子能力比镁弱 | B. | 水比硫化氢稳定 | ||
| C. | 硅酸比磷酸酸性强 | D. | 氢氧化钙比氢氧化锶碱性强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在氧化还原反应中,甲比乙失电子多 | |
| B. | 同价态阳离子,甲比乙的氧化性强 | |
| C. | 甲能与冷水反应而乙不能 | |
| D. | 将甲、乙组成原电池时,乙为负极 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 它们的原子核外电子层数随质子数的增加而增多 | |
| B. | 它们的L层电子数都相同 | |
| C. | 它们的原子核对最外层电子的引力逐渐减弱 | |
| D. | 它们与氧气或水反应时越来越剧烈 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  和 和 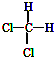 是两种种不同的物质 是两种种不同的物质 | |
| B. | 由乙烯之间的相互加成可以得到聚乙烯 | |
| C. | 丁烷与丁烯互为同系物 | |
| D. | 乙酸不能使紫色石蕊变红 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 混合气体的密度不随时间变化而变化 | |
| B. | 3v正(B)=v逆(D) | |
| C. | D的物质的量分数在混合气体中保持不变 | |
| D. | B、C、D的分子个数之比为3:2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com