
科目: 来源: 题型:选择题
| A. | K1=K2 | B. | K1<K2 | C. | K1>K2 | D. | 无法确定 |
查看答案和解析>>
科目: 来源: 题型:解答题
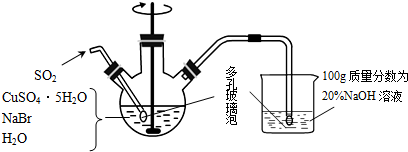
查看答案和解析>>
科目: 来源: 题型:实验题
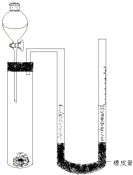 在化学研究领域,经常需要对一些物质进行性质的确定.如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:
在化学研究领域,经常需要对一些物质进行性质的确定.如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 参数 | 比较 | 解释 |
| A | 沸点 | HF<HCl<HI | 组成结构相似的物质,相对分子质量越大沸点越高 |
| B | 半径 | Na+>Al3+>S2- | 同一周期粒子半径随原子序数的递增逐渐减小 |
| C | 酸性 | H2SO3>H2CO3 | 元素的非金属性越强,其含氧酸的酸性越强 |
| D | 还原性 | P3->S2->Cl- | 元素的非金属性越强,简单阴离子的还原性越弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 以X浓度变化表示的反应速率为0.0001mol/(L•s) | |
| B. | 将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H<0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲同学说:该条件下NaHCO3的溶解度较小 | |
| B. | 乙同学说:NaHCO3不是纯碱 | |
| C. | 丙同学説:析出NaHCO3固体后的溶液中只含氯化铵和氯化钠 | |
| D. | 丁同学说:从该反应可以获得氮肥 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
| 0 | 1.20 | 0.60 | 0 | 0 |
| t1 | 0.80 | |||
| t2 | 0.20 |
| A. | 反应在t1min末的速率为v(H2)=0.2/t mol•L-1•min-1 | |
| B. | 平衡时水蒸气的转化率为66.67% | |
| C. | 该温度下反应的平衡常数为l | |
| D. | 其他条件不变,若起始时,n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时水蒸气的转化率为33.33% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com