
科目: 来源: 题型:实验题
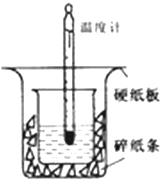 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.查看答案和解析>>
科目: 来源: 题型:解答题
 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.回答有关中和反应的问题.
已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.回答有关中和反应的问题.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 雾屑于胶体,能产生丁达尔现象 | |
| B. | 大雾的形成与汽车的尾气排放没有关系 | |
| C. | 持续大雾天气给农业生产、交通运输等带来很大的影响 | |
| D. | 空气中悬浮的细小颗粒物严重危害人体健康 |
查看答案和解析>>
科目: 来源: 题型:实验题
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定:
某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定:| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
| 实验次数 温度 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目: 来源: 题型:实验题
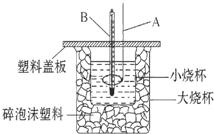
 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应;通过测定反应过程中所放出的热量可计算中和反应热.
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应;通过测定反应过程中所放出的热量可计算中和反应热.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 前20 min的平均反应速度$\overline v$(C)=0.1 mol/(L•min) | |
| B. | A的转化率为50% | |
| C. | C的平衡浓度c(C)=4 mol/L | |
| D. | B的平衡浓度c(B)=1.0 mol/L |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1min内用O2表示的反应速率为0.03 mol•L-1•min-1 | |
| B. | 该反应的平衡常数数值为7.5 | |
| C. | SO2的平衡转化率为60% | |
| D. | 降低温度,SO2平衡浓度减小 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | K1=$\frac{[{H}_{2}]^{4}}{[{H}_{2}O]^{4}}$ | |
| B. | 增大c(H2O)或减小c(H2),会使平衡常数K1减小 | |
| C. | 改变反应的温度,平衡常数K1不一定变化 | |
| D. | Fe3O4(s)+4H2(g)?3Fe(s)+4H2O(g)的平衡常数为K2,K1×K2=1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com