
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
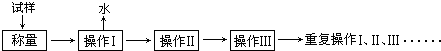
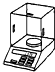 电子天平 b.
电子天平 b.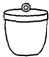 坩埚 c.
坩埚 c.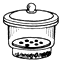 干燥器 d.
干燥器 d.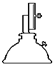 酒精喷灯
酒精喷灯| 加热前质量 | 加热后质量 | |
| m1(容器) | m2(容器+晶体) | m3(容器+无水硫酸铜) |
| 5.200g | 7.900g | 6.900g |
查看答案和解析>>
科目: 来源: 题型:解答题
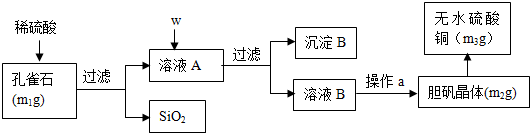
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | 相对分子质量 | 性质 |
| 废饮料瓶碎片 | 聚对苯二甲酸乙二醇酯:乳白色或浅黄色的聚合物. | |
| 乙二醇(EG) | 62 | 无色无臭液体,对动物有毒性.沸点:196~198℃,与水混溶. |
对苯二甲酸(TPA) | 166 | 白色晶体或粉末,低毒.弱酸.300℃以上升华.不溶于水、乙醚、氯仿等大多数有机溶剂,可溶于DMF等强极性有机溶剂. |
 .
. ,生产时,若消耗EG的物质的量比TPA多4‰,则上述聚合物的链节数n为250.
,生产时,若消耗EG的物质的量比TPA多4‰,则上述聚合物的链节数n为250.查看答案和解析>>
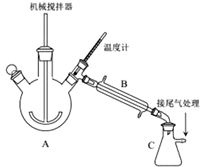
科目: 来源: 题型:解答题
查看答案和解析>>
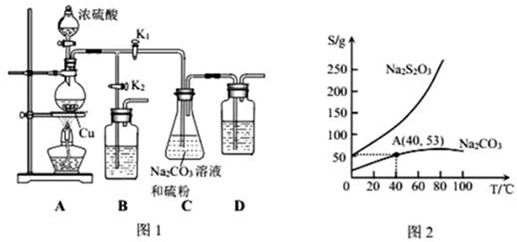
科目: 来源: 题型:解答题
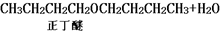
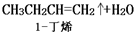
| 化合物 | 密度(g•cm-3) | 水溶性 | 沸点(℃) |
| 冰乙酸 | 1.05 | 易溶 | 118.1 |
| 正丁醇 | 0.80 | 微溶 | 117.2 |
| 正丁醚 | 0.77 | 不溶 | 142.0 |
| 乙酸正丁酯 | 0.90 | 微溶 | 126.5 |
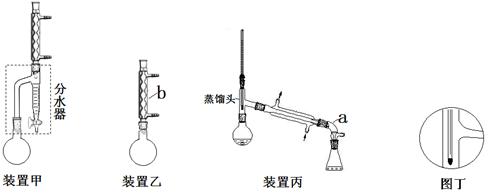


查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 气体的密度发生了变化 | B. | 气体的平均分子量发生了变化 | ||
| C. | 气体的颜色发生了变化 | D. | 体系的温度发生了变化 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com