
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
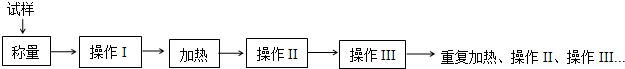
| 加热前质量 | 加热后质量 | ||
| m1 | m2 | m3 | m4 |
| 5.400g | 7.900g | 6.900g | 6.901g |
查看答案和解析>>
科目: 来源: 题型:实验题
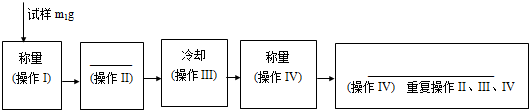
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加热后在空气中冷却称量固体 | B. | 晶体中含有加热易挥发的杂质 | ||
| C. | 实验所取晶体已有部分脱水 | D. | 晶体加热时脱水不完全 |
查看答案和解析>>
科目: 来源: 题型:实验题

| 优等品 | 一等品 | 合格品 | |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |

查看答案和解析>>
科目: 来源: 题型:解答题
 硒是人体必需的微量元素,它在元素周期表中的位置如图所示.
硒是人体必需的微量元素,它在元素周期表中的位置如图所示.| 磷 | 硫 | ||
| 砷 | 硒 |
查看答案和解析>>
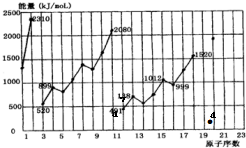
科目: 来源: 题型:选择题
| A. | 同族元素,随着核外电子层数的增加,I1逐渐增大 | |
| B. | 通常情况下,对于同一种元素的原子,其电离能I1<I2<I3 | |
| C. | 同周期元素,总体变化趋势是随着核电荷数的增加,I1增大 | |
| D. | 通常情况下,电离能越小,元素的金属性越强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①和② | B. | ①和③ | C. | ②和③ | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com