
科目: 来源: 题型:选择题
| A. | 仅能表示化学反应中伴随放出热量多少的化学方程式 | |
| B. | 能够表示化学反应中热效应的化学方程式 | |
| C. | 热效应的大小与反应的温度、压强无关,只与反应物和生成物的状态有关 | |
| D. | 当多步反应中热化学方程式相加时,相对应的热量要相减 |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 做好空气质量预报工作,以便空气污染时及时采取防护措施 | |
| B. | 推广“绿色自由”计划,吸收空气中的CO2并利用廉价能源合成汽油 | |
| C. | 将工业废水“再生”处理,用于道路保洁、城市喷泉和洗车等 | |
| D. | 利用风能、生物能发电,强制实施火力发电用煤的脱硫处理 |
查看答案和解析>>
科目: 来源: 题型:实验题
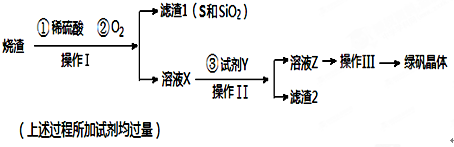
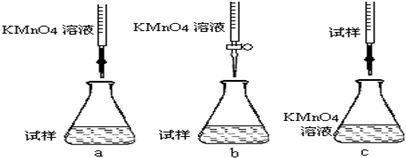
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法判断 |
查看答案和解析>>
科目: 来源: 题型:实验题
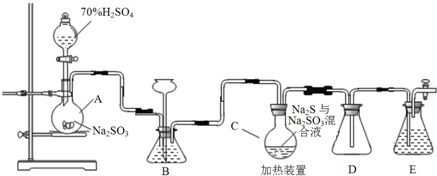
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com