
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
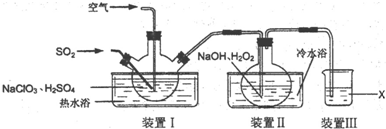
查看答案和解析>>
科目: 来源: 题型:实验题
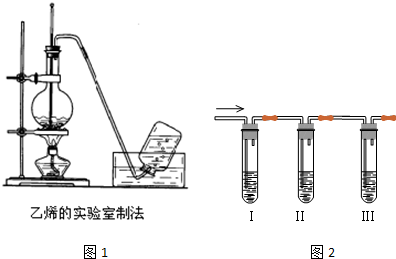
查看答案和解析>>
科目: 来源: 题型:解答题
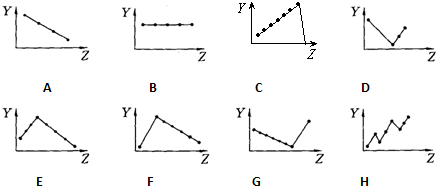
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在所有元素中,氟的第一电离能最大 | |
| B. | 氨气的水溶性大于甲烷的水溶性,原因是氨气分子之间能形成氢键 | |
| C. | 元素的金属性越强,其电负性一定越小 | |
| D. | 根据金属元素的逐级电离能数据可大致推断出此元素的最高化合价 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| C(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目: 来源: 题型:解答题
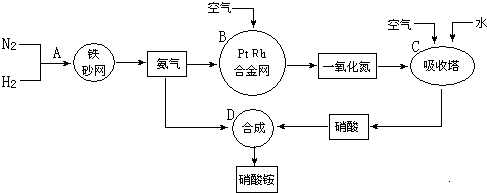
查看答案和解析>>
科目: 来源: 题型:实验题
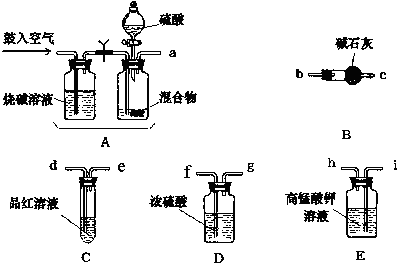
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 煤的主要成分是焦炭和无机物杂质 | |
| B. | 用家用汽车代替公交车不能达到节能减排的目的 | |
| C. | 汽车尾气的大量排放不仅会造成酸雨还可能引起光化学烟雾 | |
| D. | 添加三聚氰胺能增加奶制品的N元素含量,但是对人体有害 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com