
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
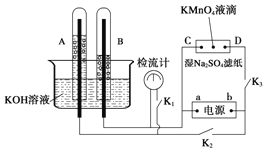 如图装置,A、B中的电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条中心的铂夹;电源有a、b两极.若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中.切断K1,闭合K2、K3通直流电,则:①标出电源的正、负极,a为负极,b为正极.
如图装置,A、B中的电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条中心的铂夹;电源有a、b两极.若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中.切断K1,闭合K2、K3通直流电,则:①标出电源的正、负极,a为负极,b为正极.查看答案和解析>>
科目: 来源: 题型:解答题
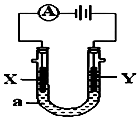 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 家用电器起火,常用液态CO2灭火,一般不用液态四氯化碳 | |
| B. | 将一氧化碳中毒者移到通风处抢救 | |
| C. | 眼睛里不慎溅进了药液,应立即用水冲洗,边洗边眨眼睛,不可用手揉眼睛 | |
| D. | 实验后,剩余的药品不能随便丢弃(或浪费),应放回原瓶 |
查看答案和解析>>
科目: 来源: 题型:解答题
 将物质的量均为3.00mol物质A、B混合于5L容器中,发生如下反应:3A+B?2C,在反应过程中C的物质的量分数随温度变化如图所示:
将物质的量均为3.00mol物质A、B混合于5L容器中,发生如下反应:3A+B?2C,在反应过程中C的物质的量分数随温度变化如图所示:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 10℃时0.1 mol/L Na2S2O3和0.1 mol/L H2SO4各 5 mL | |
| B. | 20℃时0.1 mol/L Na2S2O3和0.1 mol/L H2SO4各 5 mL | |
| C. | 10℃时0.1 mol/L Na2S2O3和0.1 mol/L H2SO4各5 mL,加水10mL | |
| D. | 20℃时0.2mol/L Na2S2O3和0.1 mol/LH2SO4各5 mL,加水10 mL |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Ag+,K+,MnO4-,Cl- | B. | Na+,H+,NO3-,SO42- | ||
| C. | K+,Ca2+,NO3-,CO32- | D. | Cu2+,Na+,Cl-,SO42- |
查看答案和解析>>
科目: 来源: 题型:实验题
 某化学活动小组设计实验(装置如图)验证氯、溴、碘及其化合物的有关物质.在硬质玻璃管中的A、B、C三处依次放置湿润的蓝色石蕊试纸、浸有NaBr溶液的棉球、浸有淀粉-KI溶液的棉球(如图所示),由左端通入足量氯气,回答下列问题:
某化学活动小组设计实验(装置如图)验证氯、溴、碘及其化合物的有关物质.在硬质玻璃管中的A、B、C三处依次放置湿润的蓝色石蕊试纸、浸有NaBr溶液的棉球、浸有淀粉-KI溶液的棉球(如图所示),由左端通入足量氯气,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com