
科目: 来源: 题型:实验题
| 实验步骤 | 肯定不存在的离子 |
| ①用PH试纸检验,溶液呈强酸性 | |
| ②取出部分溶液,加入少量CCl4和数滴新制氯水,振荡,精置CCl4层呈紫红色 | |
| ③另取出部分溶液,向其加入NaOH溶液,使溶液从酸性变为碱性,在滴加过程中及滴加完毕后,均无沉淀产生 | |
| ④取③中的部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝 | |
| ⑤另取③中的部分碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成 |
查看答案和解析>>
科目: 来源: 题型:填空题
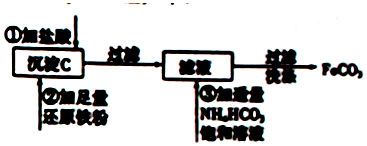
查看答案和解析>>
科目: 来源: 题型:推断题
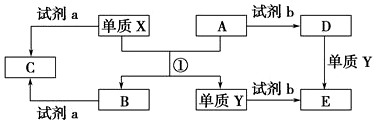
查看答案和解析>>
科目: 来源: 题型:实验题
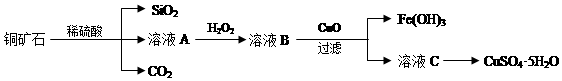
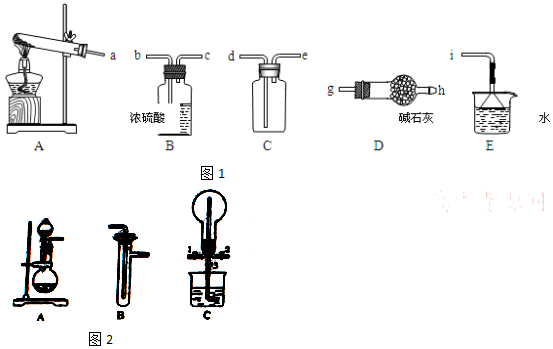
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 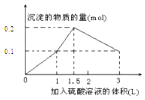 | B. | 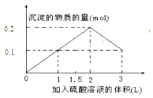 | ||
| C. | 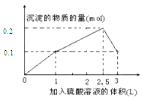 | D. | 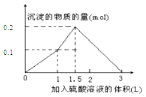 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2H2O$\frac{\underline{\;通电\;}}{\;}$ 2H2↑+O2 | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | Cl2+H2O═HC1+HC1O | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
科目: 来源: 题型:计算题
| 序号 | 氢氧化钡溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 13 |
| ② | 22.00 | 18.00 | 12 |
| ③ | 22.00 | 22.00 | 7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com