
科目: 来源: 题型:实验题
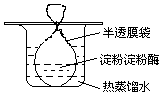 把一定量的淀粉和少量淀粉酶配成溶胶灌于半透膜袋中并置于盛有热的蒸馏水的烧杯中(如图所示).一段时间后进行如下实验,回答相关问题.
把一定量的淀粉和少量淀粉酶配成溶胶灌于半透膜袋中并置于盛有热的蒸馏水的烧杯中(如图所示).一段时间后进行如下实验,回答相关问题.查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 通入标准状况下HCl气体11.2L,可使1 L浓度为0.5mol/L的盐酸物质的量浓度增大到1mol/L | |
| B. | 在10%的NaOH溶液中,平均每9个水分子溶有1个OH- | |
| C. | 将10g碳酸钙粉末加水配成100mL溶液,CaCO3物质的量浓度为1mol/L | |
| D. | 4g NaOH溶解在10mL水中,再稀释成1L,从中取1mL,这1mL溶液的物质的量浓度为0.1mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 打破温度计水银球,用硫粉处理洒落的水银 | |
| B. | 眼睛里不慎溅进了药液,应立即用水冲洗,并且用手使劲揉眼睛 | |
| C. | 少量浓硫酸沾到皮肤上,立即用氢氧化钠溶液冲洗 | |
| D. | 不慎碰倒酒精灯,洒出的酒精在桌上燃烧时,应立即逃离实验室 |
查看答案和解析>>
科目: 来源: 题型:实验题
 用标签所示浓盐酸配制250mL 0.4mol/L的稀盐酸,并进行有关实验.请回答:
用标签所示浓盐酸配制250mL 0.4mol/L的稀盐酸,并进行有关实验.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com