
科目: 来源: 题型:实验题
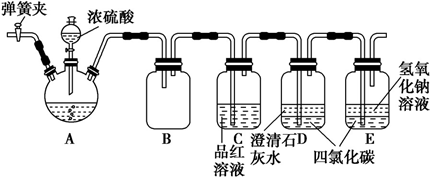
查看答案和解析>>
科目: 来源: 题型:解答题

 .
.查看答案和解析>>
科目: 来源: 题型:解答题
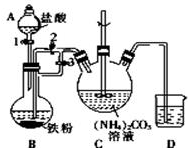 乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.
乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.查看答案和解析>>
科目: 来源: 题型:解答题
| v正 | v逆 | 平衡常数K | 转化率α |
| 增大 | 增大 | 减小 | 减小 |
| [CO2]/mol•L-1 | [H2]/mol•L-1 | [CH4]/mol•L-1 | [H2O]/mol•L-1 | |
| 平衡Ⅰ | a | b | c | d |
| 平衡Ⅱ | m | n | x | y |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a1、a2均减小 | B. | a1减小,a2增大 | C. | a1、不变,a2增大 | D. | a1不变,a2减小 |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入少量W,逆反应速率增大 | |
| B. | 因正反应吸热,所以升高温度正反应速率加快,逆反应速率减慢 | |
| C. | 当v(X)=v(Z)时,反应达到平衡 | |
| D. | 混合气体的密度不变时,反应达到平衡 |
查看答案和解析>>
科目: 来源: 题型:实验题
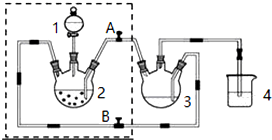
查看答案和解析>>
科目: 来源: 题型:实验题
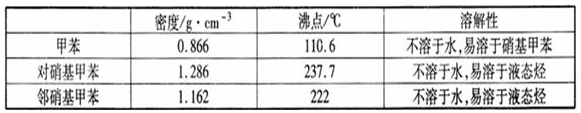
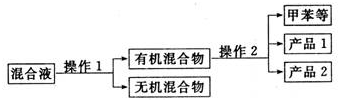
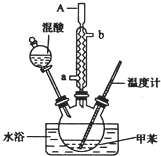 一硝基甲苯是一种重要的工业原料,某化学学习小组设计如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯).反应原理:
一硝基甲苯是一种重要的工业原料,某化学学习小组设计如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯).反应原理:
 .
.
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 平衡向正反应方向移动了 | B. | 物质R的转化率减少了 | ||
| C. | 物质X的质量分数减少了 | D. | a+b<c+d |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com