
科目: 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | |
| B. | 平衡向逆反应方向移动 | |
| C. | 平衡不移动,但容器内的压强将增大 | |
| D. | 平衡不移动,且容器内的压强不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
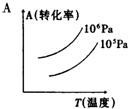 有一化学平衡mA(g)+nB(g)═PC(g)+qD(g),如图表示的转化率与压强、温度的关系.由此得出的正确结论是( )
有一化学平衡mA(g)+nB(g)═PC(g)+qD(g),如图表示的转化率与压强、温度的关系.由此得出的正确结论是( )| A. | 正反应是吸热反应,(m+n)>(p+q) | B. | 正反应是吸热反应,(m+n)<(p+q) | ||
| C. | 正反应是放热反应,(m+n)>(p+q) | D. | 正反应是放热反应,(m+n)<(p+q) |
查看答案和解析>>
科目: 来源: 题型:选择题
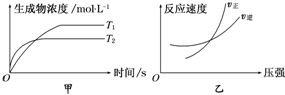
| A. | a+b>c+d T1>T2△H>0 | B. | a+b>c+d T1<T2 △H<0 | ||
| C. | a+b<c+d T1>T2△H>0 | D. | a+b>c+d T1>T2△H<0 |
查看答案和解析>>
科目: 来源: 题型:实验题
 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图:| 相对分子质量 | 密度/(g•cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
查看答案和解析>>
科目: 来源: 题型:推断题
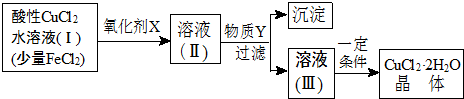
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9 | 6.7 |
查看答案和解析>>
科目: 来源: 题型:实验题
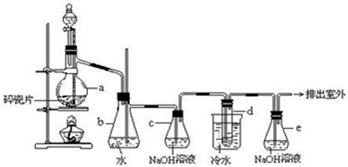
查看答案和解析>>
科目: 来源: 题型:推断题
 ;BA4的结构式
;BA4的结构式 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
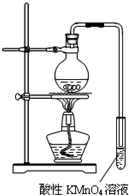 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.查看答案和解析>>
科目: 来源: 题型:解答题
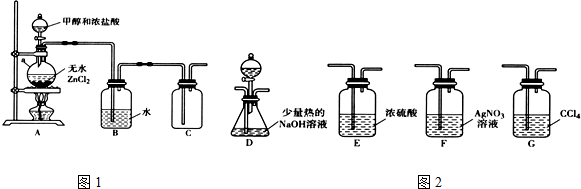
| 化学键 | C-Cl | C-Br |
| 键能(kJ•mol-1) | 330 | 276 |
| 化合物 | AgCl | AgBr |
| Ksp近似值 | 1.8×10-10 | 5×10-13 |
查看答案和解析>>
科目: 来源: 题型:解答题
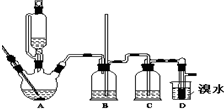 实验室制备1,2二溴乙烷的反应原理如下:
实验室制备1,2二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com