
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
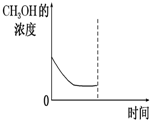 甲醚作为一种基本化工原料,由于其良好的易压缩、冷凝、汽化特性,使甲醚在制药、燃料、农药等化学工业中有许多独特的用途.
甲醚作为一种基本化工原料,由于其良好的易压缩、冷凝、汽化特性,使甲醚在制药、燃料、农药等化学工业中有许多独特的用途.| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.8 | 1.24 | ? |
查看答案和解析>>
科目: 来源: 题型:选择题
| 温度/℃ | 700 | 830 | 1200 |
| K值 | 1.7 | 1.0 | 0.4 |
| A. | 4s时,c(B)为0.76 mol•L-1 | |
| B. | 830℃到平衡时,A的转化率为80% | |
| C. | 达平衡时,升高温度,平衡正向移动 | |
| D. | 1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为0.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
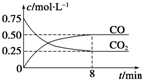 某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:
某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:| 温度/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/K CO2转化率% $\frac{n({H}_{2})}{n(C{O}_{2})}$ | 500 | 600 | 700 | 800 |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
查看答案和解析>>
科目: 来源: 题型:解答题
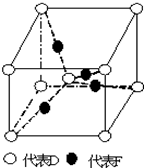 在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的$\frac{1}{4}$,F元素位于周期表的ds区,其基态原子最外能层只有一个电子.
在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的$\frac{1}{4}$,F元素位于周期表的ds区,其基态原子最外能层只有一个电子. .
.查看答案和解析>>
科目: 来源: 题型:解答题
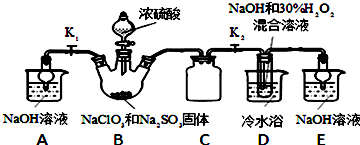
查看答案和解析>>
科目: 来源: 题型:解答题
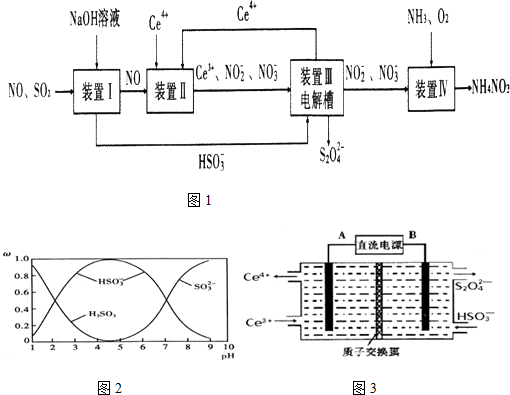
查看答案和解析>>
科目: 来源: 题型:解答题
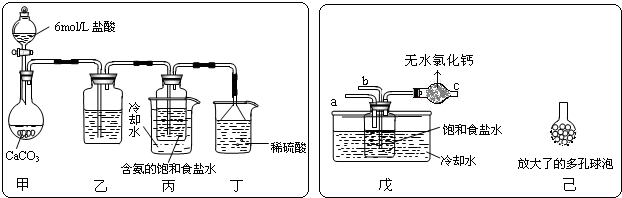
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com