
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | v(B)=1.5 mol•L-1•min-1 | B. | v(B)=3 mol•L-1•min-1 | ||
| C. | v(D)=2 mol•L-1•min-1 | D. | v(C)=1 mol•L-1•min-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
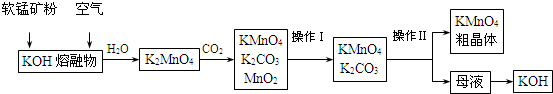
| 实验方法 | 实验现象及结论 |
| 取少量待测物于试管中,加水溶解后,滴加少量稀硫酸 | 出现无色气体溢出 |
查看答案和解析>>
科目: 来源: 题型:实验题
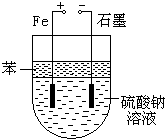 实验室用NaOH和FeSO4制取Fe(OH)2时,Fe(OH)2很容易被氧化,若采用如图所示装置制取,可以得到较纯净的Fe(OH)2.
实验室用NaOH和FeSO4制取Fe(OH)2时,Fe(OH)2很容易被氧化,若采用如图所示装置制取,可以得到较纯净的Fe(OH)2.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 升高温度,W 的体积分数减小,△H 增大 | |
| B. | 以 Y 的浓度变化表示的反应速率为 0.01 mol/(L•s) | |
| C. | 在其它条件不变的情况下,增加 1 mol X,则 X 和 Y 的转化率均提高 | |
| D. | 再向容器中通入 2 mol X 和 1 mol Y,达到平衡时,X、Y 的转化率均增大 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
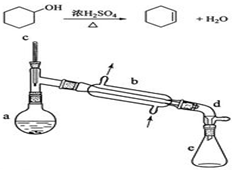 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
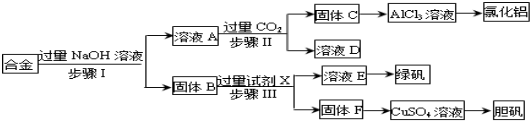
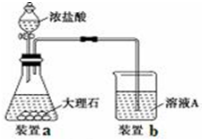

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com