
科目: 来源: 题型:选择题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 4 s时c(B)为0.38 mol/L | |
| B. | 830℃达平衡时,A的转化率为80% | |
| C. | 反应达平衡后,升高温度,平衡正向移动 | |
| D. | 1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为2.5 |
查看答案和解析>>
科目: 来源: 题型:实验题
 中学实验室用如图所示装置制取少量溴苯.请填写下列空白.
中学实验室用如图所示装置制取少量溴苯.请填写下列空白.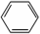 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$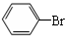 +HBr.
+HBr.查看答案和解析>>
科目: 来源: 题型:解答题
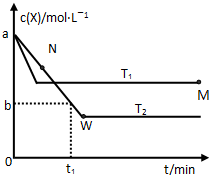 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题


查看答案和解析>>
科目: 来源: 题型:解答题
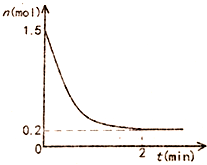 在一体积固定为10L的密闭恒温容器中充入1.5mol氨气,发生反应:2NH3(g)?N2(g)+3H2(g)△H=93KJ/mol反应容器中NH3物质的量随时间的变化如图所示:
在一体积固定为10L的密闭恒温容器中充入1.5mol氨气,发生反应:2NH3(g)?N2(g)+3H2(g)△H=93KJ/mol反应容器中NH3物质的量随时间的变化如图所示:查看答案和解析>>
科目: 来源: 题型:解答题
| 化学键 | N≡O | Cl-Cl | Cl-N | N=O |
| 键能/kJ.mol-1 | 630 | 243 | a | 607 |
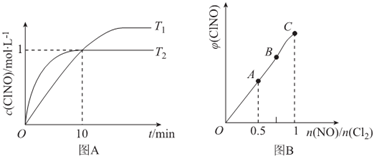
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 物质A、B的转化率之比为1:2 | |
| B. | 起始时刻和达平衡后容器中混合气体密度相等 | |
| C. | 当v正(A)=2v逆(C)时,可断定反应达到平衡状态 | |
| D. | 若起始时放入3 mol A和3 mol B,则达平衡时生成 3a mol C |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
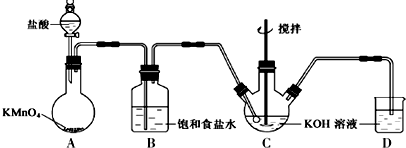
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com