
科目: 来源: 题型:解答题
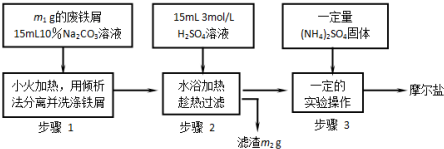
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题
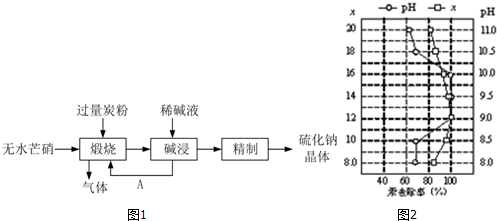
查看答案和解析>>
科目: 来源: 题型:解答题
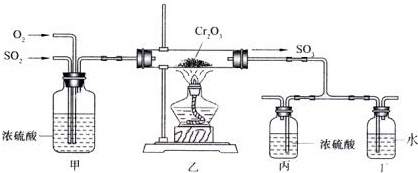
查看答案和解析>>
科目: 来源: 题型:实验题
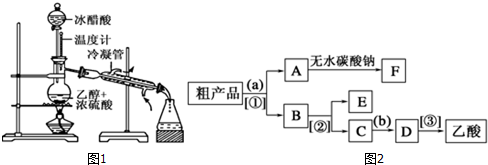
查看答案和解析>>
科目: 来源: 题型:实验题
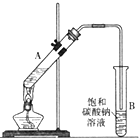 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.| 乙酸 | 乙醇 | 乙酸乙酯 | 乙醚 | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
查看答案和解析>>
科目: 来源: 题型:实验题
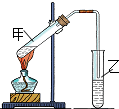 (1)“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置由乙醇、乙酸和浓硫酸来制取乙酸乙酯.回答下列问题:
(1)“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置由乙醇、乙酸和浓硫酸来制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
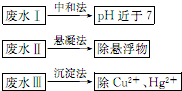 水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.
水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.查看答案和解析>>
科目: 来源: 题型:实验题
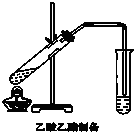 (1)为了检验和除去表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内.
(1)为了检验和除去表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内.| 物质 | 检验试剂 | 除杂试剂 |
| 甲烷(乙烯) | ||
| 酒精(水) |
查看答案和解析>>
科目: 来源: 题型:解答题
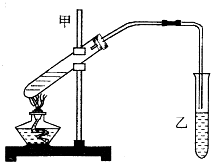 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.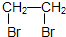 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com