
科目: 来源: 题型:选择题
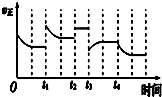 合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,在反应过程中,正反应速率的变化如图下列说法正确的是( )
合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,在反应过程中,正反应速率的变化如图下列说法正确的是( )| A. | t1时增大了压强 | B. | t2时充入了稀有气体 | ||
| C. | t3时升高了温度 | D. | t4时降低了温度 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | K=$\frac{{c}^{4}(C){c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$ | |
| B. | 增加B,平衡向右移动,B的平衡转化率增大 | |
| C. | 增大该体系的压强,平衡向左移动,化学平衡常数不变 | |
| D. | 此时B的平衡转化率是40% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | A是固体,C是气体,正反应吸热 | B. | A是气体,C是气体,正反应放热 | ||
| C. | A是气体,C是固体,正反应放热 | D. | A是气体,C是气体,正反应吸热 |
查看答案和解析>>
科目: 来源: 题型:解答题
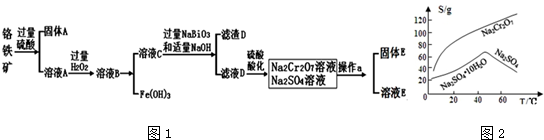
查看答案和解析>>
科目: 来源: 题型:解答题
 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2NO2 (g)?N2O4(g)△H<0 | B. | C(s)+CO2 (g)?2CO(g)△H>0 | ||
| C. | N2(g)+3H2 (g)?2NH3(g)△H<0 | D. | H2S (g)?H2 (g)+S(s)△H>0 |
查看答案和解析>>
科目: 来源: 题型:解答题
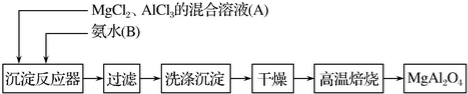
查看答案和解析>>
科目: 来源: 题型:实验题
 苯甲酸乙酯是一种无色透明液体、能与乙醇、乙醚混溶,不溶于水.用于配制香水香精和人造精油,其制备原理如下:
苯甲酸乙酯是一种无色透明液体、能与乙醇、乙醚混溶,不溶于水.用于配制香水香精和人造精油,其制备原理如下: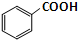 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$ +H2O
+H2O| 物质 | 颜色状态 | 密度/g•cm-3 | 熔点/℃ | 沸点/℃ |
| 苯甲酸* | 白色固体 | 1.2659 | 122 | 249 |
| 苯甲酸乙酯 | 无色液体 | 1.05 | -34.6 | 212.6 |
| 乙酸 | 无色液体 | 1.0492 | 16.6 | 117.9 |
| 乙醇 | 无色液体 | 0.789 | -117.3 | 78.5 |
| 乙酸乙酯 | 无色液体 | 0.894-0.898 | -83.6 | 77.1 |
| 乙醚 | 无色液体 | 0.713 | -116.3 | 34.6 |
查看答案和解析>>
科目: 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
如图为反应Fe + CuSO4 === FeSO4 + Cu中电子转移的关系图,则图中的元素甲、乙分别表示
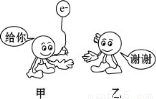
A.Fe Cu
B.Cu S
C.Fe O
D.Fe S
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在任何条件下,化学平衡常数都是一个定值 | |
| B. | 化学平衡常数K可以推断一个可逆反应进行的程度 | |
| C. | 化学平衡常数K只与温度、反应物浓度、体系的压强有关 | |
| D. | 当改变反应物的浓度时,化学平衡常数会发生改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com