
科目: 来源: 题型:多选题
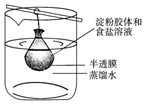 将10mL淀粉胶体和5mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图所示)2min后,分别取袋内和烧杯内液体进行实验.下列说法正确的是( )
将10mL淀粉胶体和5mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图所示)2min后,分别取袋内和烧杯内液体进行实验.下列说法正确的是( )| A. | 烧杯内液体加入硝酸银溶液后有白色沉淀产生 | |
| B. | 烧杯内液体加入碘水后呈蓝色 | |
| C. | 袋内液体加入硝酸银溶液后不会出现白色沉淀 | |
| D. | 袋内液体加入碘水后不变蓝 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 温度(℃) | 20 | 40 | 60 | 100 |
| 溶解度(g) | 5.0 | 8.7 | 14.8 | 40.2 |
| 金属阳离子 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 3.2 | 5.2 | 9.7 | 12.4 |
| 化学式 | H2CO3 | HF |
| 电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=6.75×10-4 |
查看答案和解析>>
科目: 来源: 题型:解答题
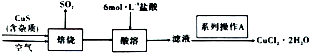
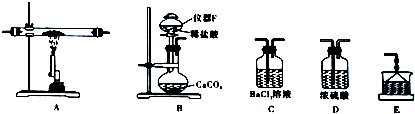
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ | |
| B. | 平衡时v正(O2)=v逆(NO) | |
| C. | 平衡后降低压强,混合气体平均摩尔质量增大 | |
| D. | 平衡后升高温度,混合气体中NO含量降低 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 相同条件下,2 mol SO2(g)和1 mol O2(g)的键能之和大于2 mol SO3(g)的键能 | |
| B. | 如将一定量的SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有2 mol SO2(g)被氧化 | |
| C. | 增大压强或升高温度,该平衡都向逆反应方向移动 | |
| D. | 将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
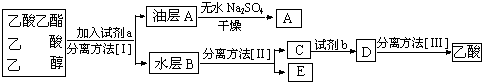
查看答案和解析>>
科目: 来源: 题型:实验题
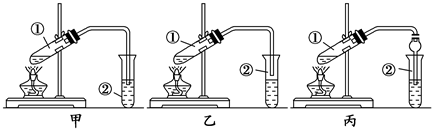
 CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com