
科目: 来源: 题型:解答题
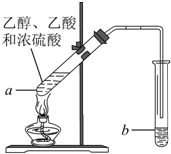 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.查看答案和解析>>
科目: 来源: 题型:解答题
 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
查看答案和解析>>
科目: 来源: 题型:解答题
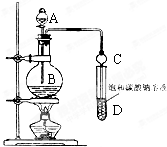
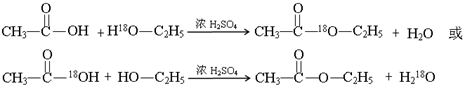 ;
;
查看答案和解析>>
科目: 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
在一 定条件下,对于A2(g)+3B2(g)
定条件下,对于A2(g)+3B2(g) 2AB3(g)反应来说,下列所表示的化学反应速率中最大的
2AB3(g)反应来说,下列所表示的化学反应速率中最大的 是
是
A.v(A2)=0.8 mol·L-1·s-1 B.v(A2)=40 mol·L-1·min-1
C.v(AB3)=1.0 mol·L-1·s-1 D.v(B2)=1.2 mol·L-1·s-1
查看答案和解析>>
科目: 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
下列说法正确的是
A.用3mL稀硫酸溶液与足量Zn反应,当气泡稀少时加入5mL浓硫酸,又迅速产生较多气泡,由上述操作及现象得出结论:硫酸浓度增大,产生H2的反应速率加快
B.FeCl3+3KSCN Fe(SCN)3(血红色) +3KCl,向溶液中加入KCl固体可快速看到血红色
Fe(SCN)3(血红色) +3KCl,向溶液中加入KCl固体可快速看到血红色
C.Ba(OH)2·8H 2O与NH4Cl的反应是放热反应
2O与NH4Cl的反应是放热反应
D.化学反应中的能量变化,通常表现为热量的变化
查看答案和解析>>
科目: 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
已知分解1 mol H2O2 放出热量98KJ,在含少量I-的溶液中,H2O2的分解机理为:H2O2+I-→H2O +IO- 慢;H2O2+IO-→H2O+O2+I- 快,下列有关反应的说法正确的是
A.反应的速率与I-的浓度有关 B. IO-也是该反应的催化剂
C.反应活化能等于98KJ·mol-1 D.v(H2O2)=v(H2O)
查看答案和解析>>
科目: 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
模型法是化学中把微观问题宏观化的最常见方法,对于反应2HBr(g) H2(g)+Br2(g),下列四个图中可以表示该反应在一定条件下为可逆反应的是
H2(g)+Br2(g),下列四个图中可以表示该反应在一定条件下为可逆反应的是
A. B.
B. C.
C. D.
D.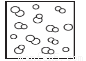
查看答案和解析>>
科目: 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
下列有关的判断或表示方法正确的是
A.一定条件下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) ΔH<-38.6 kJ·mol-1
2NH3(g) ΔH<-38.6 kJ·mol-1
B.中和热的测定实验中需要用的主要玻璃仪器:两个大小相同的烧杯、两个大小相同的量筒、温度计、环形玻璃搅拌棒,也可以用保温杯代替烧杯做有关中和热测定的实验。
C.在测定中和热的实验中,至少需要测定并记录的温度是3次
D.CO(g)的燃烧热是283.0 kJ·mol-1,则CO2分解的热化学方程式为:2CO2(g)===2CO(g)+O2(g) ΔH=+283.0 kJ·mol-1
查看答案和解析>>
科目: 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
已知:C(s)+H2O(g)===CO (g) +H2 (g) ΔH=a kJ·mol-1
2C(s)+ O2(g)===2CO (g) ΔH= - 220 kJ·mol-1
H-H、O==O和O- H键的键能分别为436、496和462 kJ·mol-1,则 a 为
H键的键能分别为436、496和462 kJ·mol-1,则 a 为
A.-332 B.+130 C.+350 D.-118
查看答案和解析>>
科目: 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
热化学方程式:C(石墨,s)+2H2(g)===CH4(g),ΔH=a
2C(石墨,s)+H2(g)===C2H2(g),ΔH=b
2C(石墨,s)+2H2(g)===C2H4(g),ΔH=c
已知:a>c>b,对下列反应:C2H2(g)+H2(g)===C2 H4(g),ΔH=x
H4(g),ΔH=x
2CH4(g)===C2H4(g)+2H2(g) ,ΔH=y,下列判断正确的是
A.x>0,y<0 B.x<0,y>0 C.x>0,y>0 D .x<0,y<0
.x<0,y<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com