
科目: 来源: 题型:实验题
 如右图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对右试管小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.
如右图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对右试管小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.查看答案和解析>>
科目: 来源: 题型:实验题
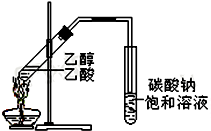 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目: 来源: 题型:实验题
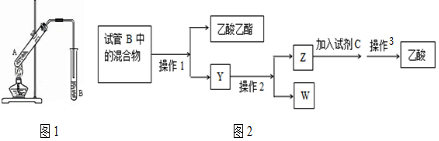
查看答案和解析>>
科目: 来源: 题型:推断题
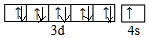 .
.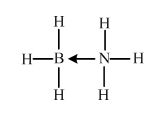 (必须标明配位键).
(必须标明配位键).查看答案和解析>>
科目: 来源: 题型:选择题
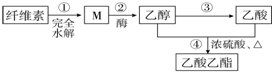
| A. | ③和④都发生了氧化还原反应 | |
| B. | M虽然分子结构中无醛基,但仍然可以发生银镜反应 | |
| C. | 步骤②,1molM完全反应可以生成3mol乙醇 | |
| D. | 若用淀粉替代纤维素,一定条件下也能按照此路线制备乙酸乙酯 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该反应为可逆反应,不可能进行到底,即乙醇的转化率一定达不到100% | |
| B. | 乙酸挥发,导致其量减少,乙醇过量,不能充分转化为乙酸乙酯 | |
| C. | 产物不稳定,易被氧化为其他物质而影响乙醇的转化率 | |
| D. | 馏出物导入饱和碳酸钠溶液液面上,有较多的乙酸乙酯溶解于水溶液中 |
查看答案和解析>>
科目: 来源: 题型:实验题
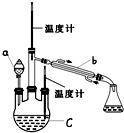 某实验小组用如图所示装置(略去加热装置)制备 乙酸乙酯.
某实验小组用如图所示装置(略去加热装置)制备 乙酸乙酯. 浓硫酸溶于乙醇不是简单的物理溶解,而是伴随着化学变化,生成硫酸乙酯和硫酸二乙酯,请写出乙醇和硫酸反应生成硫酸二乙酯的方程式2C2H5OH+H2SO4→(OC2H5)2SO2+2H2O.
浓硫酸溶于乙醇不是简单的物理溶解,而是伴随着化学变化,生成硫酸乙酯和硫酸二乙酯,请写出乙醇和硫酸反应生成硫酸二乙酯的方程式2C2H5OH+H2SO4→(OC2H5)2SO2+2H2O.| 乙醇 | 乙酸 | 乙酸乙酯 | |
| 沸点 | 78.0℃ | 117.9℃ | 77.5℃ |
| 水溶性 | 易溶 | 易溶 | 难溶 |
查看答案和解析>>
科目: 来源: 题型:解答题
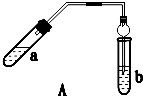
| 实验 编号 | 试管a中试剂 | 试管b中试剂 | 测得有机层的厚度/cm |
| A | 3 mL乙醇、2 mL乙酸、1mL 18mol•L-1 浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3 mL乙醇、2 mL乙酸 | 0.1 | |
| C | 3 mL乙醇、2 mL乙酸、6 mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3 mL乙醇、2 mL乙酸、盐酸 | 1.2 |
查看答案和解析>>
科目: 来源: 题型:解答题
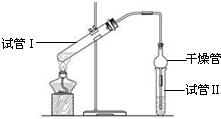 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用如图的装置制备乙酸乙酯.
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用如图的装置制备乙酸乙酯.| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层的 厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL18mol•L-1 浓硫酸 | 饱和Na2CO3 溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol•L-1 H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
查看答案和解析>>
科目: 来源: 题型:解答题
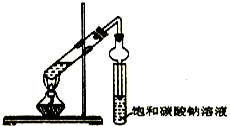 某同学用下列所示实验装置制取乙酸乙酯.回答以下问题:
某同学用下列所示实验装置制取乙酸乙酯.回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com