
科目: 来源: 题型:解答题
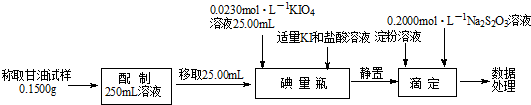
查看答案和解析>>
科目: 来源: 题型:实验题
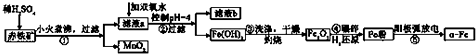
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题
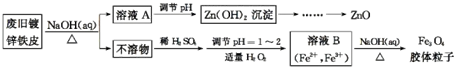
查看答案和解析>>
科目: 来源: 题型:解答题
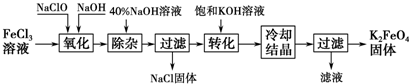
查看答案和解析>>
科目: 来源: 题型:实验题
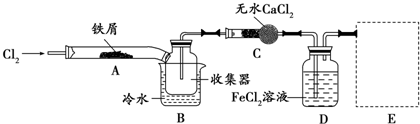
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
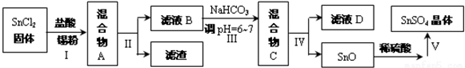
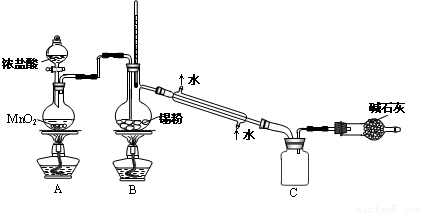
查看答案和解析>>
科目: 来源: 题型:解答题
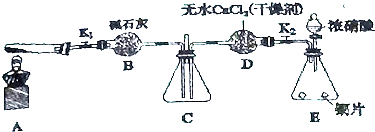
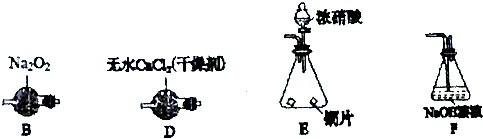
查看答案和解析>>
科目: 来源: 题型:选择题
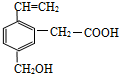 ,关于该有机物的叙述正确的是( )
,关于该有机物的叙述正确的是( )| A. | 不能跟NaOH溶液反应 | |
| B. | 能使溴的四氯化碳溶液褪色,1moL该物质因加成反应消耗溴2mol | |
| C. | 既能与乙酸发生酯化反应,又能与乙醇发生酯化反应 | |
| D. | 在足量的氧气中燃烧1mol该有机物生成H2O 7 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com