
科目: 来源: 题型:实验题
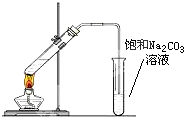 实验室可以用图所示的装置制取乙酸乙酯.回答下列问题:
实验室可以用图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3△H1+2△H2-△H3 | B. | △H1+△H2-△H3 | C. | 3△H1+△H2+△H3 | D. | 3△H1+△H2-△H3 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 温度 | 0℃ | 10℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| 溶解度(g) | 125 | 132 | 143 | 213 | 278 | 295 | 312 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | +1940 kJ•mol-1 | B. | -1940 kJ•mol-1 | C. | -485 kJ•mol-1 | D. | +485 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2NH3(g)═N2(g)+3H2(g)是熵增的反应 | |
| B. | △H、△S分别取“负”时反应一定能自发进行 | |
| C. | 在醋酸溶液中存在两种分子 | |
| D. | 相同温度下,pH值相等的盐酸和醋酸,其浓度是醋酸大于盐酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | S(g)+O2(g)=SO2(g)+Q3 Q3>297.16 kJ | |
| B. | 单斜硫和正交硫互为同分异构体 | |
| C. | 常温下单斜硫比正交硫稳定 | |
| D. | 单斜硫转化为正交硫的反应是吸热反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
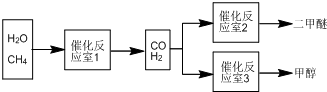
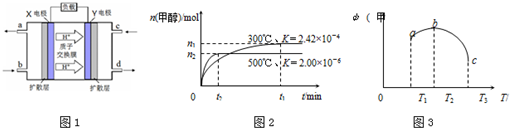
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 物质发生化学变化不一定伴随着能量变化 | |
| B. | 硫酸钡、醋酸铵、氨水都是弱电解质 | |
| C. | 向0.1 mol•L-1 Na2CO3溶液中滴加酚酞,溶液变红色 | |
| D. | 在温度、压强一定的条件下,自发反应总是向△H-T△S<0的方向进行 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | S的燃烧热为△H=-297.23kJ/mol | |
| B. | S(s)→S(g) 吸收热量 | |
| C. | S(g)+O2 (g)═SO2 (g) 放出的热量小于297.23kJ | |
| D. | 形成1mol SO2化学键所释放总能量大于断裂1molS(s)和1molO2 (g)的化学键所吸收的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com