
科目: 来源: 题型:解答题
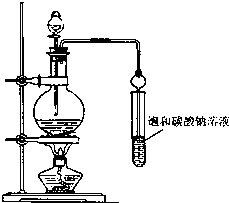 实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇和少量浓H2SO4混合,然后经分液漏斗边滴加醋酸,边加热蒸馏,直接收集蒸馏产品可得到含有乙醇、乙醚、醋酸、少量水的乙酸乙酯粗产品.据此回答问题:
实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇和少量浓H2SO4混合,然后经分液漏斗边滴加醋酸,边加热蒸馏,直接收集蒸馏产品可得到含有乙醇、乙醚、醋酸、少量水的乙酸乙酯粗产品.据此回答问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目: 来源: 题型:解答题
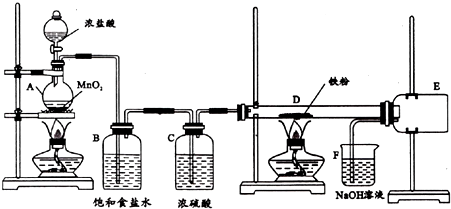
查看答案和解析>>
科目: 来源: 题型:解答题
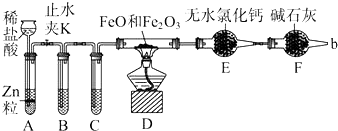
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验时,试管口应高于试管底 | |
| B. | 加热时试管内铁粉红热,点燃肥皂泡可听到爆鸣声 | |
| C. | 反应的化学方程式为:2Fe+3H2O(g) $\frac{\underline{\;\;△\;\;}}{\;}$ Fe2O3+3H2 | |
| D. | 实验结束后如果固体仍为黑色,说明原反应没有发生 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
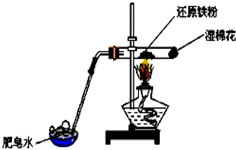
 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物加热,并通入水蒸气,就可以完成“高温下,Fe与水蒸气的反应实验”.
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物加热,并通入水蒸气,就可以完成“高温下,Fe与水蒸气的反应实验”.查看答案和解析>>
科目: 来源: 题型:解答题
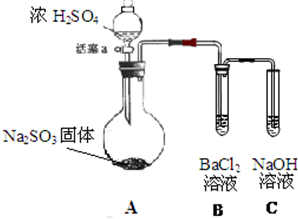 某同学设计了如下实验装置图.(夹持装置和加热装置略,气密性已检验):
某同学设计了如下实验装置图.(夹持装置和加热装置略,气密性已检验):查看答案和解析>>
科目: 来源: 题型:填空题
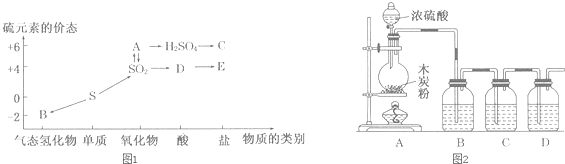
查看答案和解析>>
科目: 来源: 题型:解答题
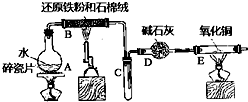 某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)请回答下列问题:
某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
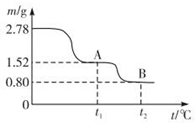
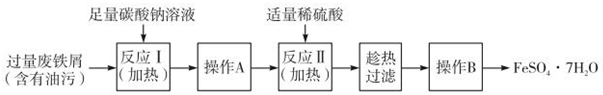
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com