
科目: 来源: 题型:解答题
| T/℃ | 活性氧百分含量 | 产率 |
| 5~10 | 13.94 | 85.49 |
| 10~15 | 14.02 | 85.78 |
| 15~20 | 15.05 | 88.38 |
| 20~25 | 14.46 | 83.01 |
查看答案和解析>>
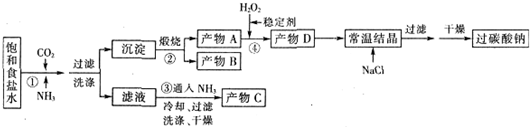
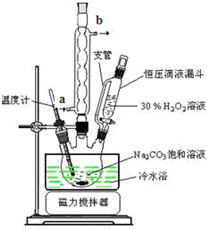
科目: 来源: 题型:实验题
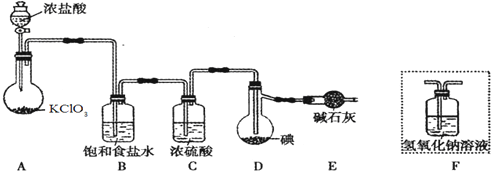
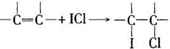
查看答案和解析>>
科目: 来源: 题型:实验题
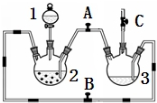 某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.| 实验次数 | 第一次 | 第二次来 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
科目: 来源: 题型:解答题
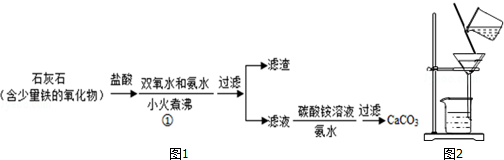
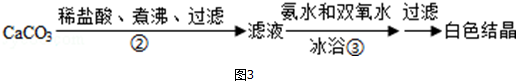
查看答案和解析>>
科目: 来源: 题型:实验题
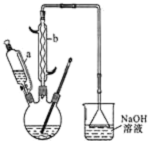
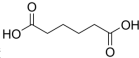 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图: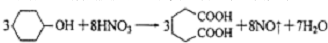
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
| 乙二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时,1.44g,25℃时2.3g,易溶于乙醇,不溶于苯 | 146 |
查看答案和解析>>
科目: 来源: 题型:解答题
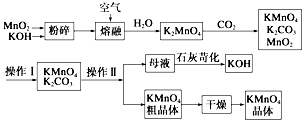
查看答案和解析>>
科目: 来源: 题型:解答题
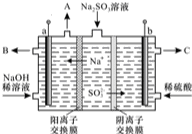 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
查看答案和解析>>
科目: 来源: 题型:解答题
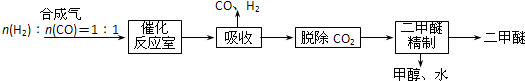
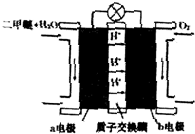
查看答案和解析>>
科目: 来源: 题型:实验题
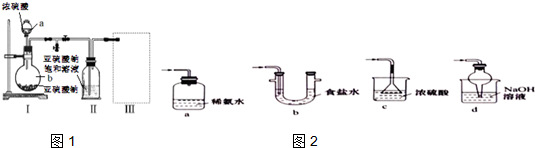
查看答案和解析>>
科目: 来源: 题型:实验题
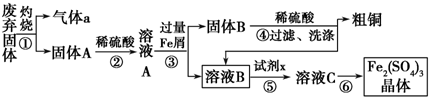
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com