
科目: 来源: 题型:解答题
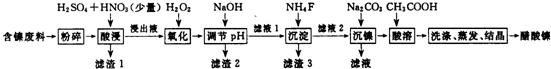
| 表1 | 表2 | |||
| 物质 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) |
| Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
| Fe2+ | 5.8 | 8.8 | NiF | 可溶 |
| Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
| Ni2+ | 6.7 | 9.5 | NiCO3 | KSP=9.60×10-6 |
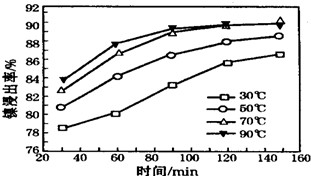
查看答案和解析>>
科目: 来源: 题型:解答题
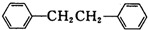 )是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
)是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
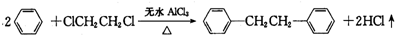
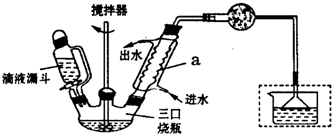
| 名称 | 相对分子质量 | 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶水,易溶乙醇 |
| 1,2-二氯化烷 | 99 | 1.27 | -35.3 | 83.5 | 难溶水,可溶苯 |
| 无水氯化铝 | 133.5 | 2.44 | 190 | 178(升华) | 遇水分解,微溶苯 |
| 联苄 | 182 | 0.98 | 52 | 284 | 难溶水,易溶苯 |
查看答案和解析>>
科目: 来源: 题型:解答题
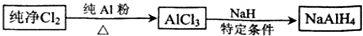
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
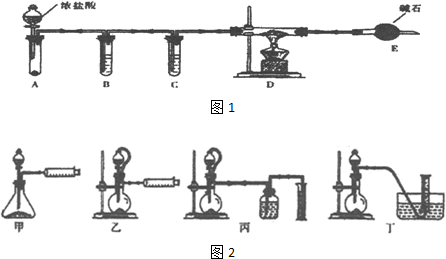
 图是实验室制乙酸乙酯的装置.
图是实验室制乙酸乙酯的装置.查看答案和解析>>
科目: 来源: 题型:解答题
时间s 浓度mol/L | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||

查看答案和解析>>
科目: 来源: 题型:解答题
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为黄色 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有还原性 |
| ② | 在FeCl3溶液中加入足量铁粉 | 溶液由黄色变为浅绿色 | Fe+2Fe3+=3Fe2+ | Fe3+具有氧化性 |
| ③ | 在FeCl3溶液中滴入适量KI溶液和淀粉溶液 | 溶液最终变为蓝色 | 2Fe3++2I-═2Fe2++I2 | Fe3+具有氧化性 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
| B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
| D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
| E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
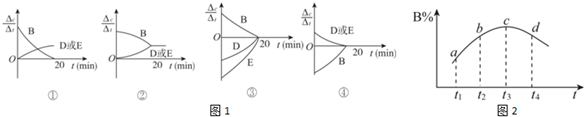
查看答案和解析>>
科目: 来源: 题型:解答题
| Fe3O4 | Fe2O3 | Fe | |
| 分解温度/°C | 1538 | 1400 | - |
| 熔点/°C | - | - | 1535 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com