
科目: 来源: 题型:解答题
| |温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
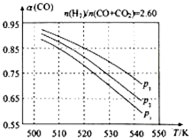 甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:| 物质 | CO | CO2 | H2 | CH3OH(g) |
| 标准生成热(kJ/mol) | -110.52 | -393.51 | 0 | -201.25 |
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |||
| CH3OH(g) | CH3OCH3(g) | H2O(g) | CH3OCH3(g) | H2O(g) | ||
| a | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
| b | 387 | 0.40 | 0 | 0 | ||
| c | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
查看答案和解析>>
科目: 来源: 题型:实验题
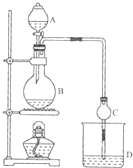 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液. 已知
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液. 已知| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| t/s | 0 | 500 | 1 000 | 1 500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1=125,1 000 s时转化率为50% | |
| C. | 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L•min) | |
| B. | 6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L•min) | |
| C. | 反应至6min时,c(H2O2)=0.3mol/L | |
| D. | 反应至6min时,H2O2分解了50% |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| B. | 对于能够自发进行的吸热反应,其原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | △H<0、△S>0的反应在温度低时不能自发进行 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com